题目内容
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚![]() ,同时利用此装置的电能在铁上镀铜,下列说法正确的是
,同时利用此装置的电能在铁上镀铜,下列说法正确的是
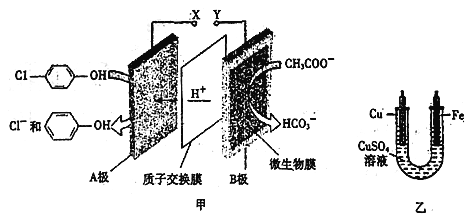
A. 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.2NA
B. A极的电极反应式为![]()
C. 铁电极应与Y相连接
D. 反应过程中甲中右边区域溶液pH逐渐升高
【答案】C
【解析】A项,根据正极的电极反应式![]()
![]() ,可知外电路有
,可知外电路有![]() 电子转移时,消耗的
电子转移时,消耗的![]() 是
是![]() ,因此从B极流经质子交换膜到达A电极的
,因此从B极流经质子交换膜到达A电极的![]() 个数为
个数为![]() 故A项错误;B项,由题可知
故A项错误;B项,由题可知![]() 移向A电极,因此结合图中信息知A电极发生的反应为
移向A电极,因此结合图中信息知A电极发生的反应为![]() ,故B项错误;C项,乙与甲相连时,甲相当于是电源与乙构成电解池,乙中的
,故B项错误;C项,乙与甲相连时,甲相当于是电源与乙构成电解池,乙中的![]() 活泼性大于
活泼性大于![]() ,要在
,要在![]() 上镀铜,则
上镀铜,则![]() 极发生还原反应,
极发生还原反应,![]() 应是电解池的阴极与甲中原电池的负极相连,由图中信息可知A极得电子生成
应是电解池的阴极与甲中原电池的负极相连,由图中信息可知A极得电子生成![]() ,故A是正极,B是负极,所以
,故A是正极,B是负极,所以![]() 电极应与Y相连,故C项正确; D项,在反应过程中,甲右边区域是原电池的负极,发生氧化反应,发生的电极反应为
电极应与Y相连,故C项正确; D项,在反应过程中,甲右边区域是原电池的负极,发生氧化反应,发生的电极反应为![]() ,生成
,生成![]() ,溶液的
,溶液的![]() 应该逐渐减小,故D项错误。综上所述,本题正确答案为C。
应该逐渐减小,故D项错误。综上所述,本题正确答案为C。

练习册系列答案
相关题目