题目内容
在MnO2和浓盐酸的反应中,如果有17.4 g MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢的物质的量是多少?(已知: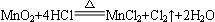 )
)
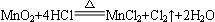 )
)29.2 g 0.400 mol
从元素的化合价变化分析可知,4摩尔氯化氢只有2摩尔被氧化,设参加反应的氯化氢物质的量为x,则被氧化的氯化氢为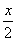 ,将17.4 g MnO2换算为0.2 mol,列比例计算如下:
,将17.4 g MnO2换算为0.2 mol,列比例计算如下:
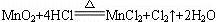
1 mol 4 mol
0.2 mol x
 ,解得:x="0.800" mol。则
,解得:x="0.800" mol。则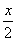 ="0.400" mol。
="0.400" mol。
0.800 mol的氯化氢的质量为0.800 mol×36.5 g·mol-1="29.2" g。
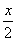 ,将17.4 g MnO2换算为0.2 mol,列比例计算如下:
,将17.4 g MnO2换算为0.2 mol,列比例计算如下: 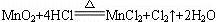
1 mol 4 mol
0.2 mol x
 ,解得:x="0.800" mol。则
,解得:x="0.800" mol。则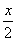 ="0.400" mol。
="0.400" mol。0.800 mol的氯化氢的质量为0.800 mol×36.5 g·mol-1="29.2" g。

练习册系列答案
相关题目
 K2MnO4+K3MnO4+MnO2+3O2↑
K2MnO4+K3MnO4+MnO2+3O2↑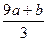 )mol
)mol