题目内容
【题目】钙和铜合金可用作电解制钙的阴极电极材料,回答下列问题:
(1)基态铜原子的价电子排布式为_________________。
(2)CaCO3高温分解可制得CaO。CaO与 C 在一定条件下可生成CaC2,CaC2与水反应生成 Ca(OH)2和一种 4 原子气体分子。
①CaCO3中阴离子的空间构型为______________。
②该气体分子中 σ 键与π键的数目之比为_____________。
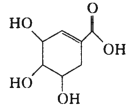
③写出 2 种与 ![]() 互为等电子体的分子的化学式______________。
互为等电子体的分子的化学式______________。
(3)工业上电解 CaCl2制Ca而不采用电解 CaO 的原因是_______________。
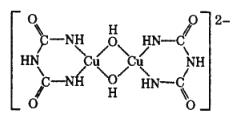
(4)在碱性溶液中,缩二脲 HN( CONH2)2与 CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为__________、________。
(5)一种钙铜合金的结构可看作图a、b 两种原子层交替堆积排列而成c,其晶胞如图d。
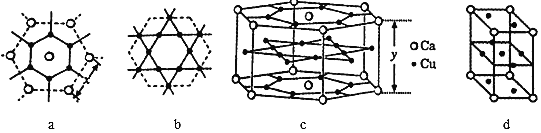
①a图Ca-Ca 间距离为x pm,c图中Ca-Ca间距离为y pm。已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为_______。
②设阿伏加德罗常数的值为 NA,则该钙铜合金的密度是_______gcm-3(列出计算表达式)。
【答案】3d104s1 平面三角形 3:2 CO、N2 CaO熔点高于CaCl2,熔化时消耗能量高 sp2 sp3 18 ![]()
【解析】
(1)根据基态Cu原子的外围电子排布为写出价电子排布式;
(2)①CaCO3中K2CO3中阴离子为CO32-,中心碳原子形成1个碳氧双键和2个碳氧单键,阴离子的空间构型为平面三角形;
②该气体为C2H2,分子中2个单键,1个三键,一个单键就有一个σ键,三键中有一个σ键和2个π键;
③![]() 离子中共有14个电子;
离子中共有14个电子;
(3) CaO熔点高于CaCl2,熔化时消耗能量高;
(4)缩二脲分子中碳原子以单键和双键结合与氮原子以单键结合;
(5)①以上面面心上的Ca原子为例,该晶胞中该Ca原子配位的Cu原子包含其上面6个、相同层6个、下层6个,所以其配位数是18;
②根据均摊法求出一个晶胞的质量和体积,再根据![]() =
=![]() 计算晶体密度。
计算晶体密度。
(1)基态Cu原子的外围电子排布为:3d104s1,则基态Cu原子的价电子排布式为3d104s1,故答案为:3d104s1;
(2)①CaCO3中K2CO3中阴离子为CO32-,中心碳原子形成1个碳氧双键和2个碳氧单键,阴离子的空间构型为平面三角形,故答案为:平面三角形;
②该气体为C2H2,分子中2个单键,1个三键,一个单键就有一个σ键,三键中有一个σ键和2个π键,分子中σ键与π键数目比为3:2,故答案为:3:2;
③![]() 离子中共有14个电子,符合的有CO、N2,故答案为:CO、N2;
离子中共有14个电子,符合的有CO、N2,故答案为:CO、N2;
(3)氧化钙熔点比氯化钙熔点高,熔融离子晶体要消耗能源,从而增加成本,为减少成本,所以用熔融氯化钙冶炼钙,故答案为:CaO熔点高于CaCl2,熔化时消耗能量高;
(4)缩二脲分子中碳原子以单键和双键结合,分子中的C原子采取sp2杂化,氮原子以单键结合分子中的N原子采取sp3杂化,故答案为:sp2;sp3;
(5)①以上面面心上的Ca原子为例,该晶胞中该Ca原子配位的Cu原子包含其上面6个、相同层6个、下层6个,所以其配位数是18,故答案为:18;
②根据c可知,该晶胞中Ca原子个数=12×![]() +2×
+2×![]() =3、Cu原子个数=12×
=3、Cu原子个数=12×![]() +6×
+6×![]() +6=15,该晶胞体积=[
+6=15,该晶胞体积=[![]() (x×10-10)2sin60°×6× (x×10-10)]cm3=
(x×10-10)2sin60°×6× (x×10-10)]cm3=![]() x2y×10-30cm3,晶体密度=
x2y×10-30cm3,晶体密度=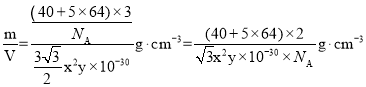 ,故答案为:
,故答案为:![]() 。
。

【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2