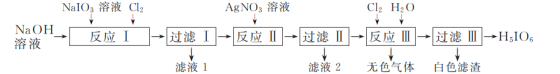
题目内容
【题目】25℃时,用 0.1molL-1NaOH溶液滴定 20 mL 0.1 molL-1 某二元弱酸 H2A ( Ka1 =1.1×10-3,Ka2= 3.9×10-6 )溶液,滴定过程中溶液的 pH 变化曲线如图所示。下列说法正确的是
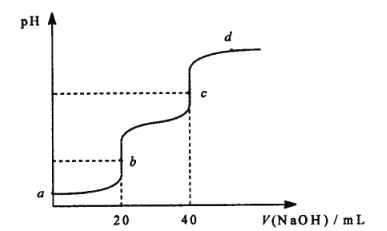
A.a 点的pH 大于2
B.b 点溶液中c(H2A) > c(A2-)
C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)
D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)
【答案】C
【解析】
A. a 点发生H2A的电离且Ka1>>Ka2,故Ka1=c(HA)×c(H+)/c(H2A)=1.1×10-3,则c2(H+)=1.1×10-3×0.1,解得c(H+)≈1.05×10-2,故pH小于2,A项错误;
B. b点酸碱恰好完全反应生成NaHA,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=c(HA-)+c(A2-)+c(H2A),得到:c(H2A)+c(H+)=c(A2-)+c(OH-),则c(H2A)<c(A2-),B项错误;
C. c点为Na2A,溶液显碱性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=2c(HA-)+2c(A2-)+2c(H2A),得到:c(HA-)+2c(H2A )=c(OH- )-c(H+),C项正确;
D. d点为Na2A和NaOH的混合物,溶液显碱性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),D项错误;
答案选C。

 阅读快车系列答案
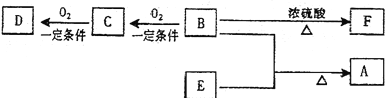
阅读快车系列答案【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。请回答下列问题:
(1)步骤②中,H2C2O4稍过量的主要原因是________。
(2)为了提高步骤③得到的FeC2O4·2H2O的纯度,宜用________(填“热水”“冷水”或“无水乙醇”)洗涤,检验洗涤是否干净的操作是________。
(3)实现步骤④必须用到的两种仪器是________(供选仪器:a. 烧杯;b. 坩埚;c. 蒸馏烧瓶;d. 高温炉;e. 表面皿;f. 锥形瓶)。
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
10 | 20 | 30 | 40 | 50 | 60 | |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | — | — |
(NH4)2Fe(SO4)2·6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(注意:高于73.3℃,FeSO4·7H2O发生分解)
以铁屑(有油污)、硫酸、硫酸铵为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,______,冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_____至铁屑完全溶解,_____,冷却结晶,用无水乙醇洗涤2~3次,低温干燥。[实验中必须使用的试剂:铁屑、1.0 mol·L-1的Na2CO3溶液、3.0 mol·L-1的H2SO4溶液,饱和(NH4)2SO4溶液]
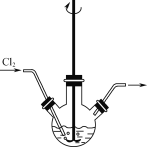
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
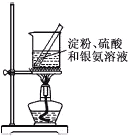
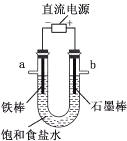
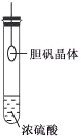
A.用铂丝蘸取NaCl溶液置于酒精灯火焰上灼烧,火焰呈黄色 | B.将少量银氨溶液加入盛有淀粉和硫酸的试管中,加热,产生光亮的银镜 | C.饱和食盐水通电一段时间后,湿润的KI-淀粉试纸遇b处气体变蓝色 | D.将胆矾晶体悬挂于盛有浓H2SO4的密闭试管中,蓝色晶体逐渐变为白色 |
A. A B. B C. C D. D