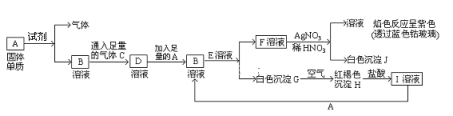
��Ŀ����
����Ŀ��ijУ��ѧС��ѧ��������ͼ����װ�ý���������ˮ��Ӧ����ʵ�飬�����ò����һ����ȡFeCl3��6H2O���塣(ͼ�мгּ�β������װ�þ�����ȥ)
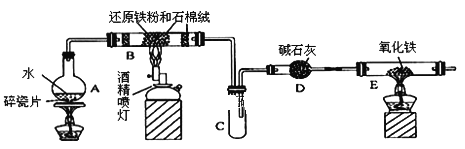
(1)װ��B�з�����Ӧ�Ļ�ѧ����ʽ��________________________________��
(2)װ��E�е�������______________________________________________��
(3)װ��C���Ҳർ��Ϊʲô�Ȳ������Թܵײ����ֲ�ֻ�����Թ�һ��㣬����Ҫԭ����___________��
(4)ֹͣ��Ӧ����B����ȴ��ȡ���еĹ��壬�������ϡ�����ַ�Ӧ�����ˣ���С��ѧ������������Һ��ȡFeCl3��6H2O����,����������£�
![]()
�ٲ���һ��ͨ������Cl2������Ӧ�����ӷ���ʽΪ_______________________________________��
�ڲ��������FeCl3ϡ��Һ�еõ�FeCl36H2O�������Ҫ��������______________.
���𰸡�3Fe+4H2O![]() Fe3O4+4H2�� ��ɫ��Ϊ��ɫ �ų�C�п�������ʹ������ˮ����˳������D 2Fe2+ +Cl2=2Fe3+ +2Cl- ����Ũ������ȴ�ᾧ������
Fe3O4+4H2�� ��ɫ��Ϊ��ɫ �ų�C�п�������ʹ������ˮ����˳������D 2Fe2+ +Cl2=2Fe3+ +2Cl- ����Ũ������ȴ�ᾧ������
��������
��1��������ˮ�����ڸ����·�����Ӧ����������������������
��2��װ��B����ˮ������Ӧ���ɵ�����������ʯ�Ҹ�������װ��E�����������������ȷ�����Ӧ����������ˮ��
��3����������ʹ�����ݳ������̣��������ų�������
��4��Һ�к����������ӣ�����ͨ����������Ҫ�ǽ���������������Ϊ�������������õ�FeCl3��6H2O���������Ũ������ȴ�ᾧ��������
��1��װ��B��������ˮ�����ڸ����·�����Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe+4H2O![]() Fe3O4+4H2����
Fe3O4+4H2����
�ʴ�Ϊ��3Fe+4H2O![]() Fe3O4+4H2����
Fe3O4+4H2����
��2��װ��B����ˮ������Ӧ���ɵ�����������ʯ�Ҹ�������װ��E�����������������ȷ�����Ӧ����������ˮ�����Է�Ӧ������Ϊ����ɫ�ķ�ĩ��ɺ�ɫ���ܱڲ���ˮ�飬�ʴ�Ϊ����ɫ��Ϊ��ɫ��
��3����������ʹ�����ݳ������̣��������ų�������������Ҫԭ�����ų�C�п�������ʹ������ˮ����˳������D���ʴ�Ϊ���ų�C�п�������ʹ������ˮ����˳������D��
��4������Һ�к����������ӣ�����ͨ����������Ҫ�ǽ���������������Ϊ���������ӣ���Ӧ�����ӷ���ʽΪ��2Fe2+ +Cl2=2Fe3+ +2Cl-���ʴ�Ϊ��2Fe2+ +Cl2=2Fe3+ +2Cl-��
����FeCl3ϡ��Һ�еõ�FeCl3��6H2O���������Ũ������ȴ�ᾧ�����ˣ��ʴ�Ϊ������Ũ������ȴ�ᾧ��������

����Ŀ��N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��
2N2O5(g)![]() 4NO2(g)+ O2(g) ��H>0
4NO2(g)+ O2(g) ��H>0
T1�¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±���
ʱ��/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol��L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
����˵���в���ȷ����
A��500 s��N2O5�ֽ�����Ϊ2.96�w10-3mol��L-1��s-1
B��T1�¶��µ�ƽ�ⳣ��ΪK1=125��ƽ��ʱN2O5��ת����Ϊ50%
C��T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1>T2����K1��K2
D����ƽ��������������䣬�����������ѹ����ԭ����1/2����c(N2O5)> 5.00 mol��L-1