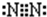题目内容
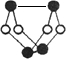
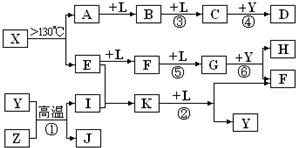
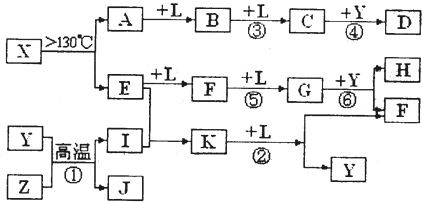
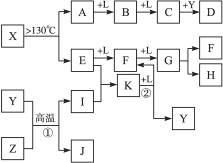
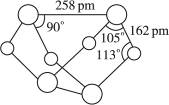
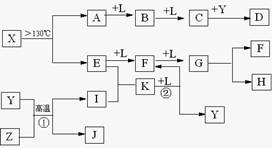
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。
试回答下列问题
(1)写出化学式:D X 。
(2)E的电子式为: 。
(3)写出化学方程式:① ;② 。
(1)H2SO4; S4N4 (或N4S4)(2)![]()
(3)3Fe+4H2O(g)![]() Fe3O4+4H2; 4NH3+5O2
Fe3O4+4H2; 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
解析:
本题考查无机推断。A为淡黄色固体,且为单质,可知为硫,B的相对分子质量比A大32,可以推出B为SO2,C的相对分子质量比B大16,C为SO3,J是磁铁矿的主要成分,J是Fe3O4,从框图可知,L是O2,Y是一种常见的液体,C与Y生成重要化工产品D,可知Y是H2O,D是H2SO4,由反应①的条件和产物J可以猜测反应①为3Fe+4H2O(g)![]() Fe3O4+4H2,Z是Fe,I是H2。H、K均是重要的工业产品,从E、F、G之间的转化特征,可知E是N2,N2与H2反应生成K,K是NH3,反应②是NH3与O2的催化氧化,生成NO和H2O,符合框图,F是NO,NO与O2继续反应生成NO2,G是NO2,NO2与水反应生成硝酸和NO,H是硝酸。最后由A和E,以及X分子的球棍模型可得X是S4N4。
Fe3O4+4H2,Z是Fe,I是H2。H、K均是重要的工业产品,从E、F、G之间的转化特征,可知E是N2,N2与H2反应生成K,K是NH3,反应②是NH3与O2的催化氧化,生成NO和H2O,符合框图,F是NO,NO与O2继续反应生成NO2,G是NO2,NO2与水反应生成硝酸和NO,H是硝酸。最后由A和E,以及X分子的球棍模型可得X是S4N4。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目