题目内容
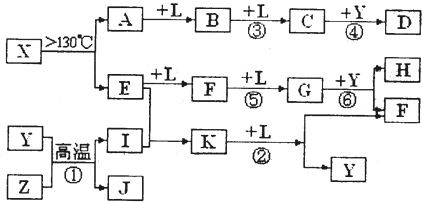
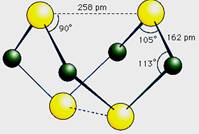
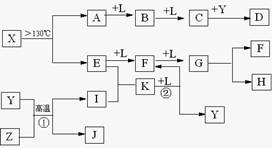
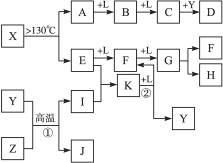
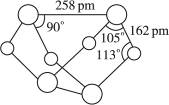
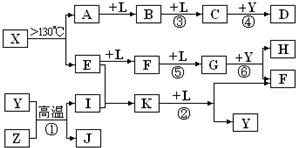
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁,D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18.下列框图中部分反应条件已略去.
试回答下列问题:
(1)下列有关X的说法正确的是
A.该物质的分子式为S4N4
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
(2)E的电子式为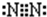
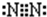 ,D的分子式
,D的分子式
(3)写出反应②的化学方程式:
(4)J与过量H的稀溶液反应的离子方程式为


试回答下列问题:
(1)下列有关X的说法正确的是
AB
AB
.A.该物质的分子式为S4N4
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
(2)E的电子式为
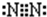
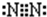
H2SO4
H2SO4
,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是④
④
.(填序号)(3)写出反应②的化学方程式:
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(4)J与过量H的稀溶液反应的离子方程式为
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
.分析:A、E、I、L是常见的非金属单质,其中A为淡黄色固体,A为S单质,A
B
C,B的相对分子质量比A大32,C的相对分子质量比B大16,B为SO2,C为SO3,L为O2,Y是一种常见的液体,结合C+Y→D可知,Y为H2O,D为H2SO4;
X→A+E,A为S单质,故X含有S元素,组成X的两种元素的相对原子质量相差18,E是常见的非金属单质,故E元素的相对原子质量为32-18=14,故E为N2,由X分子的球棍模型可知,X为S4N4,由E
F
G可知,F为NO,G为NO2,由G
H+F,结合Y为水,H是重要的化工产品,故H为HNO3,F为NO;
J是磁性氧化铁Fe3O4,Y为H2O,Z是常见的金属单质,I是常见的非金属单质,结合Y+Z→I+J,故Z为Fe,I为H2,由E+I→K,结合E为N2,可知K为NH3,K
F+Y为NH3+O2→NO+H2O,符合转化关系与题意.
| L |
| L |
X→A+E,A为S单质,故X含有S元素,组成X的两种元素的相对原子质量相差18,E是常见的非金属单质,故E元素的相对原子质量为32-18=14,故E为N2,由X分子的球棍模型可知,X为S4N4,由E
| L |
| L |
| Y |
J是磁性氧化铁Fe3O4,Y为H2O,Z是常见的金属单质,I是常见的非金属单质,结合Y+Z→I+J,故Z为Fe,I为H2,由E+I→K,结合E为N2,可知K为NH3,K
| L |
解答:解:A、E、I、L是常见的非金属单质,其中A为淡黄色固体,A为S单质,A
B
C,B的相对分子质量比A大32,C的相对分子质量比B大16,B为SO2,C为SO3,L为O2,Y是一种常见的液体,结合C+Y→D可知,Y为H2O,D为H2SO4;
X→A+E,A为S单质,故X含有S元素,组成X的两种元素的相对原子质量相差18,E是常见的非金属单质,故E元素的相对原子质量为32-18=14,故E为N2,由X分子的球棍模型可知,X为S4N4,由E
F
G可知,F为NO,G为NO2,由G
H+F,结合Y为水,H是重要的化工产品,故H为HNO3,F为NO;
J是磁性氧化铁Fe3O4,Y为H2O,Z是常见的金属单质,I是常见的非金属单质,结合Y+Z→I+J,故Z为Fe,I为H2,由E+I→K,结合E为N2,可知K为NH3,K
F+Y为NH3+O2→NO+H2O,
(1)A、由X分子的球棍模型可知,X为S4N4,故A正确;
B、由原子大小可知,黑色球是S原子,白色球是N原子,分子中N-S是极性键,N-N是非极性键,故B正确;
C、由结合可知及X的不稳定性可知,该物质属于分子晶体,熔、沸点较低,故C错误;
D、同素异形体的研究对象是单质,S4N4与S2N2是属于化合物,故D错误;
关系AB;
(2)E为N2,分子中N原子之间形成3对共用电子对,电子式为: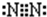 ;D为H2SO4;
;D为H2SO4;
反应①是Fe+H2O→Fe3O4+H2,属于氧化还原反应,反应②是NH3+O2→NO+H2O,属于氧化还原反应,
反应③是SO2+O2→SO3,属于氧化还原反应,反应④是SO3+H2O→H2SO4,属于非氧化还原反应,
反应⑤是NO+O2→NO2,属于氧化还原反应,反应⑥是NO2+H2O→HNO3+NO,属于氧化还原反应,
故属于非氧化还原反应的是 ④;
故答案为: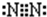 ;H2SO4;④;
;H2SO4;④;
(3)反应②是氨气与氧气反应生成一氧化氮与水,反应方程式为:4NH3+5O2
4NO+6 H2O;
故答案为:4NH3+5O2
4NO+6 H2O;
(4)硝酸具有强氧化性,Fe3O4过量稀硝酸溶液反应,生成硝酸铁与NO、水,Fe3O4中+2与+3的铁我这里之比为1:2,反应离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O.
| L |
| L |
X→A+E,A为S单质,故X含有S元素,组成X的两种元素的相对原子质量相差18,E是常见的非金属单质,故E元素的相对原子质量为32-18=14,故E为N2,由X分子的球棍模型可知,X为S4N4,由E
| L |
| L |
| Y |
J是磁性氧化铁Fe3O4,Y为H2O,Z是常见的金属单质,I是常见的非金属单质,结合Y+Z→I+J,故Z为Fe,I为H2,由E+I→K,结合E为N2,可知K为NH3,K
| L |
(1)A、由X分子的球棍模型可知,X为S4N4,故A正确;
B、由原子大小可知,黑色球是S原子,白色球是N原子,分子中N-S是极性键,N-N是非极性键,故B正确;
C、由结合可知及X的不稳定性可知,该物质属于分子晶体,熔、沸点较低,故C错误;
D、同素异形体的研究对象是单质,S4N4与S2N2是属于化合物,故D错误;
关系AB;
(2)E为N2,分子中N原子之间形成3对共用电子对,电子式为:
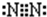 ;D为H2SO4;
;D为H2SO4;反应①是Fe+H2O→Fe3O4+H2,属于氧化还原反应,反应②是NH3+O2→NO+H2O,属于氧化还原反应,
反应③是SO2+O2→SO3,属于氧化还原反应,反应④是SO3+H2O→H2SO4,属于非氧化还原反应,
反应⑤是NO+O2→NO2,属于氧化还原反应,反应⑥是NO2+H2O→HNO3+NO,属于氧化还原反应,
故属于非氧化还原反应的是 ④;
故答案为:
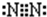 ;H2SO4;④;
;H2SO4;④;(3)反应②是氨气与氧气反应生成一氧化氮与水,反应方程式为:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(4)硝酸具有强氧化性,Fe3O4过量稀硝酸溶液反应,生成硝酸铁与NO、水,Fe3O4中+2与+3的铁我这里之比为1:2,反应离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O.
点评:本题以无机框图题的形式考查N、S、Fe等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写能力,A为淡黄色固体单质,Y是一种常见的液体,J是磁性氧化铁等均为解题突破口,结合转化关系利用顺推与逆推相结合推理判断,(4)中离子方程式的书写是易错点,难点,容易忽略发生氧化还原反应,X是学生未知知识,需要结合A、B与结构式进行推理,对学生的逻辑推理能力提出较高要求.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目