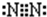题目内容
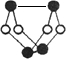
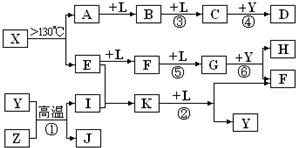
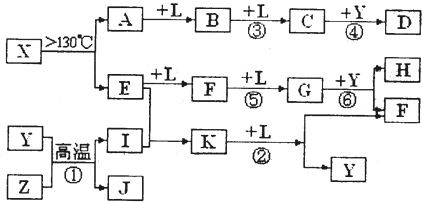
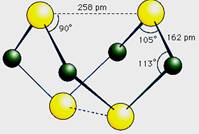
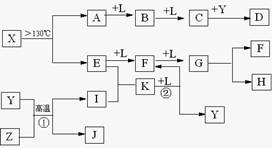
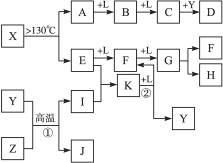
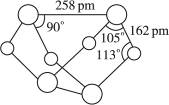
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J俗称磁性氧化铁,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。
试回答下列问题:
(1)写出化学式:D____________、X____________。
(2)E的电子式为________________________。
(3)写出化学方程式:①______________________________________;
②____________________________________________________________。
(1)H2SO4 S4N4 (或N4S4)
![]()
(3)3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
解析:
A为单质S,B的相对分子质量比A大32,相当于增加的为一分子氧气的相对分子质量,B可能为SO2,再结合“C的相对分子质量比B大16”可推知L为O2;“Z是常见的金属单质,J俗称磁性氧化铁”,可以推出Z为Fe;反应Y+Z→I+J为3Fe + 4H2O![]() Fe3O4+ 4H2,Y为H2O、I为H2,结合图示可知D为H2SO4;由X分子的球棍模型可知,形成X分子的两种元素分别形成三个共价键、两个共价键,即分别在ⅤA、ⅥA,结合单质E两步催化氧化可知E为N2,F为NO,G为NO2,那么K为NH3,4NH3+5O2
Fe3O4+ 4H2,Y为H2O、I为H2,结合图示可知D为H2SO4;由X分子的球棍模型可知,形成X分子的两种元素分别形成三个共价键、两个共价键,即分别在ⅤA、ⅥA,结合单质E两步催化氧化可知E为N2,F为NO,G为NO2,那么K为NH3,4NH3+5O2![]() 4NO+6H2O,再回扣检查一遍。
4NO+6H2O,再回扣检查一遍。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目