题目内容
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、二氧化硅等17种物质重点改变过人类世界。
(1)铁原子在基态时,价电子排布式为__________________________________。
(2) 硝酸钾中NO3-的空间构型为________,写出与NO3-互为等电子体的一种非极性分子化学式_________________________________。
(3)6-氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有___________。

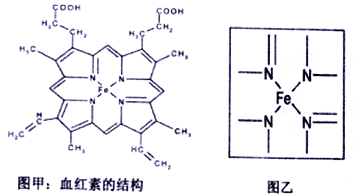
(4)下图甲所示为血红素的结构。血红素中四种非金属元素的电负性由小到大的顺序是_______请在图乙中用适当的方式标出配位键________。
(5)在二氧化硅晶体中,硅原子的价电子层原子轨道发生了杂化,杂化的方式是______,O-Si-O 夹角是____________________。
【答案】 3d64s2 平面正三角形 BF3 (SO3、BBr3等) C、N、O、S H<C<N<O  sp3 10928
sp3 10928
【解析】(1)铁原子在基态时,价电子排布式为3d64s2。
(2)硝酸钾中NO3-与BF3是等电子体,故其空间构型与BF3相似,为平面正三角形,与NO3-互为等电子体的非极性分子有BF3 (SO3、BBr3等)。
(3)由6-氨基青霉烷酸的结构可知,其中采用SP3杂化的原子有C、N、O、S等4种原子。
(4)血红素中四种非金属元素的电负性由小到大的顺序是H<C<N<O。中心原子形成的配位键如图所示: 。
。
(5)在二氧化硅晶体中,硅原子的价电子层原子轨道发生了杂化,由于每个硅原子与周围4个氧原子形成了4个σ键,所以其杂化方式是sp3;由于每个硅原子与周围4个氧原子形成了正四面体结构(硅原子位于正四面体的中心),所以,O-Si-O夹角是10928。

【题目】下列表格中各项分类都正确的一组是
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 生铁 | 黄铜 | 液态氯化氢 | SO2 |
B | 硫酸钠 | 水银 | 石墨 | 食盐水 |
C | 洁净的空气 | 盐酸 | CuSO4溶液 | 蔗糖 |
D | 氢氧化钠 | 澄清石灰水 | AgCl | CO |
A.AB.BC.CD.D