题目内容
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.NH3的结构式为: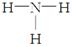 | B.乙烯的结构简式: CH2CH2 |
C.CH4分子的比例模型: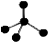 | D.-CH3(甲基)的电子式为: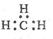 |
A
解析试题分析:B选项要标出乙烯的官能团C=C出来,故B选项是错误的,应为CH2=CH2,C选项为球棍模型故C选项是错误的。D选项甲基是指甲烷失去一个氢原子后后剩下的电中性的一价基团,故甲基的电子式应为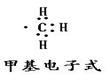
考点:主要考察物质的结构的相关知识点

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(原创)能用键能大小解释的是
| A.稀有气体一般很难发生化学反应 |
| B.常温常压下,氟气的密度小于氯气 |
| C.相同条件下,NH3在水中的溶解度大于PH3 |
| D.SiC晶体的熔点比晶体硅的高 |
下列说法中错误的是
| A.CO2、SO3都是极性分子 |
| B.KF是离子化合物,HF为共价化合物 |
| C.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
下列晶体属于离子晶体的是
| A.镁 | B.干冰 | C.氟化钾 | D.金刚石 |
下列结构中,从成键情况看,不合理的是
A. | B.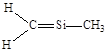 | C.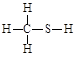 | D.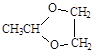 |
下列物质中都是既含有离子键又含有共价键的一组是( )
| A.NaOH, H2O, NH4Cl |
| B.KOH, Na2O2, (NH4)2S |
| C.MgO,CaBr2, NaCl |
| D.Na2SO4, HCl, MgCl2 |
下列各组中的分子,全部是以极性键形成非极性分子的是
| A.H2、N2、Cl2 | B.CH4、NH3、H2O |
| C.HCl、NO、Br2 | D.CO2、CS2、CCl4 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CO2和H2 | C.NaCl和HCl | D.CCl4和KCl |
下列分子的中心原子的杂化类型与其他不同的是
| A.SiCl4 | B.H2S | C.PCl5 | D.NH3 |