题目内容
下列说法中错误的是
| A.CO2、SO3都是极性分子 |
| B.KF是离子化合物,HF为共价化合物 |
| C.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
A
解析试题分析:A、CO2、SO3都是非极性分子,A不正确;B、KF含有离子键,是离子化合物,HF含有共价键,为共价化合物,B正确;C、在NH4+和[Cu(NH3)4]2+中都存在配位键,且都是氮原子通过孤对电子,C正确;D、对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,则PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构,D正确,答案选A。
考点:考查分子极性、化合物、配位键以及8电子稳定结构判断

练习册系列答案
相关题目
以下几种物质:①白磷、②单晶硅、③甲烷、④四氯化碳,具有正四面体构型的分子的是( )
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
下列说法错误的是
| A.含有共价键的化合物一定是共价化合物 |
| B.在共价化合物中一定含有共价键 |
| C.含有离子键的化合物一定是离子化合物 |
| D.双原子单质分子中的共价键一定是非极性键 |
下列说法不正确的是
| A.在共价化合物中一定含有共价键 |
| B.含有离子键的化合物一定是离子化合物 |
| C.含有共价键的化合物一定是共价化合物 |
| D.化学反应过程中,反应物分子内的化学键断裂,产物分子的化学键形成 |
中心原子采取sp2杂化的是 ( )
| A.NH3 | B.BCl3 | C.PCl3 | D.H2O |
下列推断正确的是 ( )
| A.BF3是三角锥形分子 |
B.NH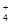 的电子式: 的电子式: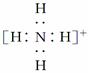 ,离子呈平面形结构 ,离子呈平面形结构 |
| C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 |
| D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3 σ键 |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.NH3的结构式为: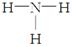 | B.乙烯的结构简式: CH2CH2 |
C.CH4分子的比例模型: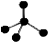 | D.-CH3(甲基)的电子式为: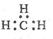 |
下列说法中,不正确的是( )
| A.双原子分子中的共价键,一定是非极性键 |
| B.非极性键也可能存在于离子化合物中 |
| C.分子间作用力,又叫范德华力,它比化学键要弱得多 |
| D.共价化合物在液态时不能导电 |