题目内容
【题目】已知H2(g)+![]() O2(g)===H2O(g),反应过程中能量变化如下图,问:
O2(g)===H2O(g),反应过程中能量变化如下图,问:
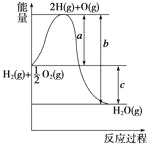
(1)a、b、c分别代表什么意义?
a______________;b____________;c__________。
(2)该反应是放热反应还是吸热反应?__________。ΔH大于零还是小于零?________
(3)若已知2H2(g)+O2(g)===2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)===2H2O(l) ΔH2=-Q2
则ΔH1______ΔH2,Q1______Q2(填“>”、“<”或“=”)。
【答案】(1)代表旧键断裂吸收的能量 代表新键形成释放出的能量 代表反应热
(2)放热反应 小于零 (3)> <
【解析】(1)H2(g)和![]() O2(g)与2H(g)和O(g)之间的能量差是H2—→2H(g)和
O2(g)与2H(g)和O(g)之间的能量差是H2—→2H(g)和![]() O2(g)
O2(g)![]() O(g)过程中断开H—H键和O=O键需吸收的能量。所以a代表旧键断裂吸收的能量,b代表2H(g)+O(g)结合成氢氧键所放出的能量,c则代表断键所吸收的能量-成键所释放的能量,即a-b=c。
O(g)过程中断开H—H键和O=O键需吸收的能量。所以a代表旧键断裂吸收的能量,b代表2H(g)+O(g)结合成氢氧键所放出的能量,c则代表断键所吸收的能量-成键所释放的能量,即a-b=c。
(2)由图可知该反应中反应物总能量大于生成物总能量,所以该反应为放热反应,ΔH<0。
(3)比较ΔH大小时,要连同“+”、“-”包含在内,类似于数学上的正负数比较,如果只比较反应放出热量多少,则只比较数值大小,与“+”、“-”无关。

练习册系列答案
相关题目