题目内容
【题目】如图所示为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。

请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为 。
(2)AB段曲线所表示的反应的离子方程式为 。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是 。
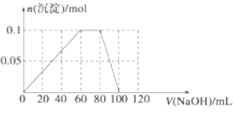
(4)向含有0.1mol NH4Al(SO4)2的溶液中逐滴加入5mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

【答案】
(1)1:3;(2)Al(OH)3+OH-=[Al(OH)4]-;
(3)生成白色沉淀
(4)
【解析】
试题分析:(1)分析图象可知,A点是氯化铝和氢氧化钠反应生成氢氧化铝和氯化钠的反应,反应的化学方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,A点时已参加反应的AlCl3和NaOH的物质的量之比为1:3,故答案为:1:3;
(2)AB段是氢氧化铝沉淀溶解的过程,反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)向B处生成的溶液中通入二氧化碳,可发生反应2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,反应生成白色沉淀,故答案为:生成白色沉淀;
(4)含有0.1mol NH4Al(SO4)2溶液中含有NH4+离子0.1mol,Al3+物质的量为0.1mol,逐滴加入5molL-1 NaOH溶液,发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3H2O,Al(OH)3+OH-=AlO2-+H2O,先生成氢氧化铝沉淀需要消耗氢氧化钠物质的量为0.3mol,体积=![]() =0.060L=60ml,和铵根离子反应消耗氢氧化钠物质的量为0.1mol,氢氧化钠溶液体积=
=0.060L=60ml,和铵根离子反应消耗氢氧化钠物质的量为0.1mol,氢氧化钠溶液体积=![]() =0.020L=20ml,生成氢氧化铝沉淀物质的量量为0.1mol,溶解需要氢氧化钠物质的量为0.1mol,消耗氢氧化钠溶液的体积为20ml,依据沉淀量和消耗氢氧化钠溶液体积描出图象为
=0.020L=20ml,生成氢氧化铝沉淀物质的量量为0.1mol,溶解需要氢氧化钠物质的量为0.1mol,消耗氢氧化钠溶液的体积为20ml,依据沉淀量和消耗氢氧化钠溶液体积描出图象为 ,故答案为:
,故答案为: 。
。