题目内容
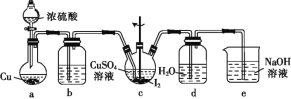
【题目】酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、妨织等工业。乙酸乙酯的实验室制法常采用如图装置:
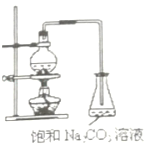
(1)烧瓶中除了乙酸和乙醇之外,还必须加的药品是___,其作用是___。
(2)能不能把饱和Na2CO3溶液换成饱和NaCl溶液?___,为什么?___。
(3)为了乙酸和乙醇回流,减少它们损失,该装置应该改进之处是:___。
(4)分离乙酸乙酯和饱和溶液,所需要的操作是___。
【答案】浓硫酸 催化剂和脱水剂 不能 NaCl溶液不能与乙酸反应除去乙酸 采用回流措施 分液
【解析】
⑴主要的药品有乙酸、乙醇、浓硫酸。
⑵饱和碳酸钠溶液与乙酸反应除去乙酸、溶解乙醇,同时降低乙酸乙酯的溶解度,便于分层,而NaCl溶液不能与乙酸反应除去乙酸。
⑶为了乙酸和乙醇回流,减少它们损失,采用回流措施。
⑷用分液分离出乙酸乙酯。
⑴烧瓶中除了乙酸和乙醇之外,还必须加的药品是浓硫酸;浓硫酸作催化剂和脱水剂;故答案为:浓硫酸;催化剂和脱水剂。
⑵饱和碳酸钠溶液与乙酸反应除去乙酸、溶解乙醇,同时降低乙酸乙酯的溶解度,便于分层,而NaCl溶液不能与乙酸反应除去乙酸;故答案为:不能;NaCl溶液不能与乙酸反应除去乙酸。
⑶为了乙酸和乙醇回流,减少它们损失,该装置应该改进之处是:采用回流措施;故答案为:采用回流措施。
⑷乙酸乙酯和碳酸钠饱和溶液是不溶的,采用分液的方法分离,故答案为:分液。

 名校课堂系列答案
名校课堂系列答案【题目】由下列实验及现象不能得出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向浓度均为 |
| 非金属性: |
B. | 向含有酚酞的 | 观察到红色变浅 | 证明 |
C | 室温下,用pH试纸测 |
|
|
D. | 向盛有10滴 | 有黄色沉淀生成 |
|
A.AB.BC.CD.D
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
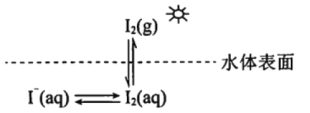
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。
的反应速率慢,反应程度小。
①I-在酸性条件下与![]() 反应的离子方程式是_____________________________________。
反应的离子方程式是_____________________________________。
②在酸性条件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到
通入到![]() 下列试剂中,一段时间后,记录实验现象与结果。己知:每
下列试剂中,一段时间后,记录实验现象与结果。己知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂组成 | 反应前溶液的 | 反应后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 约10% | |
乙 |
| 5.1 | 4.1 | 约100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明![]() 在实验乙中的作用并解释_______________________。
在实验乙中的作用并解释_______________________。