题目内容
【题目】把铝条放入盛有过量稀硫酸的试管中,不能加快氢气产生速率的是( )
A.改铝条为镁条B.滴加少量![]() 溶液
溶液
C.不用稀硫酸改用98%的浓![]() D.升高溶液的温度
D.升高溶液的温度
【答案】C
【解析】
A.因镁的金属活泼性较铝高,因此将铝条换成镁条会增加产生氢气的速率,故A不符合题意;
B.滴加少量CuSO4溶液,因氧化性:Cu2+>H+,滴加少量的CuSO4溶液时,Cu2+先发生反应而被置换出铜单质,溶液中形成了Al-稀硫酸-Cu原电池,可加快产生氢气的速率,故B不符合题意;
C.换成浓硫酸后,若反应温度较低,则会产生钝化,不会反应产生氢气,若温度较高,反应会产生二氧化硫气体,不会产生氢气,故C符合题意;
D.升高溶液温度,有效碰撞频率将会增加,化学反应速率将加快,故D不符合题意;
故答案为C。

【题目】由下列实验及现象不能得出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向浓度均为 |
| 非金属性: |
B. | 向含有酚酞的 | 观察到红色变浅 | 证明 |
C | 室温下,用pH试纸测 |
|
|
D. | 向盛有10滴 | 有黄色沉淀生成 |
|
A.AB.BC.CD.D
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
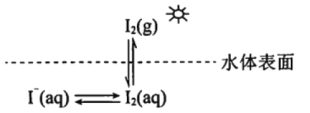
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。
的反应速率慢,反应程度小。
①I-在酸性条件下与![]() 反应的离子方程式是_____________________________________。
反应的离子方程式是_____________________________________。
②在酸性条件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到
通入到![]() 下列试剂中,一段时间后,记录实验现象与结果。己知:每
下列试剂中,一段时间后,记录实验现象与结果。己知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂组成 | 反应前溶液的 | 反应后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 约10% | |
乙 |
| 5.1 | 4.1 | 约100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明![]() 在实验乙中的作用并解释_______________________。
在实验乙中的作用并解释_______________________。