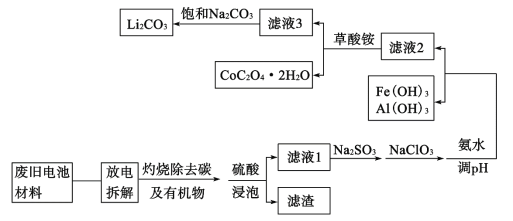
题目内容
【题目】氧化还原反应在化学研究和工业生产中意义重大。在一定条件可发生如下两个氧化还原反应:
①Fe+ H2SO4(浓)![]() Fe2(SO4)3+ SO2↑+H2O(未配平)
Fe2(SO4)3+ SO2↑+H2O(未配平)
②3S+6KOH![]() 2K2S+ K2SO3+3H2O
2K2S+ K2SO3+3H2O
试回答下列问题:
(1)反应①中氧化产物为____________,当反应中生成标准状况下6.72LSO2气体时,被还原的H2SO4的物质的量为____________mol。
(2)反应②中,还原剂与氧化剂的物质的量之比为______________,若反应中有4.816×1023个电子发生转移时,消耗S的质量为___________________________。
【答案】Fe2(SO4)3 0.3 1:2 19.2 g
【解析】
①![]() 反应中,S元素化合价降低,被还原,H2SO4是氧化剂,生成SO2为还原产物,Fe元素化合价升高,被氧化,Fe是还原剂,生成Fe2(SO4)3为氧化产物,转移电子数为6e-,据此分析解答;
反应中,S元素化合价降低,被还原,H2SO4是氧化剂,生成SO2为还原产物,Fe元素化合价升高,被氧化,Fe是还原剂,生成Fe2(SO4)3为氧化产物,转移电子数为6e-,据此分析解答;
(2)②反应中S既是氧化剂又是还原剂,氧化剂得到还原产物K2S,还原剂得到氧化产物K2SO3;根据转移电子计算参加反应的S的质量。
(1)①![]() 反应中,Fe元素化合价升高,被氧化,Fe是还原剂,生成Fe2(SO4)3为氧化产物;S元素化合价降低,被还原,H2SO4是氧化剂,生成SO2为还原产物,则生成标准状况下6.72LSO2气体时,被还原的H2SO4有
反应中,Fe元素化合价升高,被氧化,Fe是还原剂,生成Fe2(SO4)3为氧化产物;S元素化合价降低,被还原,H2SO4是氧化剂,生成SO2为还原产物,则生成标准状况下6.72LSO2气体时,被还原的H2SO4有![]() =0.3mol,故答案为:Fe2(SO4)3;0.3;
=0.3mol,故答案为:Fe2(SO4)3;0.3;
(2)②反应中S既是氧化剂又是还原剂,氧化剂得到还原产物K2S,还原剂得到氧化产物K2SO3,由还原产物、氧化产物的化学计量数,可知反应中氧化剂与还原剂的物质的量之比为2:1;由![]() 方程式可知消耗3molS转移电子为1mol×(4-0)=4mol,所以有4.816×1023个即
方程式可知消耗3molS转移电子为1mol×(4-0)=4mol,所以有4.816×1023个即![]() =0.8mol电子发生转移时,消耗S的质量为
=0.8mol电子发生转移时,消耗S的质量为![]() ×3×32=19.2 g;故答案为:2:1;19.2 g。
×3×32=19.2 g;故答案为:2:1;19.2 g。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案