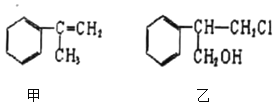
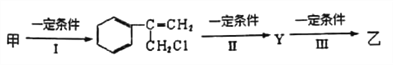
题目内容
【题目】向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
【答案】B
【解析】
用硫酸溶解后,得到的产物加KSCN溶液,无血红色出现,说明得到的产物是硫酸亚铁,即混合物中的铁元素全在硫酸亚铁中,用足量的CO在高温下还原相同质量的混合物得到的铁和加入硫酸的硫酸亚铁中的铁相等,硫酸的物质的量为:1mol/L×0.05L=0.05mol,根据硫酸根守恒,则n(Fe)=n(FeSO4)=n(H2SO4)=0.05mol,m(Fe)=0.05mol![]() 56g/mol=2.8g,即能得到铁的质量为2.8g。答案选B。
56g/mol=2.8g,即能得到铁的质量为2.8g。答案选B。

【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
C6H12O6溶液![]()
![]()
![]()
![]() 悬浊液
悬浊液![]()
![]()
![]() Ca(C6H11O7)2
Ca(C6H11O7)2
请回答下列问题:
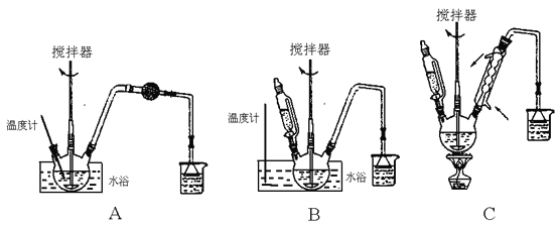
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是________。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是______。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是______________________;本实验中不宜用CaCl2替代CaCO3,理由是_________________________________。
(3)第③步需趁热过滤,其原因是______________________________________。
(4)第④步加入乙醇的作用是_________________________________________。
(5)第⑥步中,下列洗涤剂最合适的是________________________________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
【题目】物质的分类是学习化学的一种重要方法,科学合理的分类对于系统掌握知识、提高学习效率、解决问题都有着重要的意义。
请回答下列问题:
(1)纯净物根据其组成和性质有如图分类形式,这种分类方法层次分明、简洁直观。

①图中所示所属的分类方法为___________。
②现有碳、一氧化碳、二氧化碳、碳酸氢钠四种物质,采用下列分类标准,无法将其中两种物质归为一类的是___________________。
A.具有还原性 B.属于氧化物 C.碳元素化合价相同 D.属于电解质
③实验室常根据物质分类的原则存放药品,某学校实验室其中的四个药品柜已经存放了如下部分药品,实验室新购进一些晶体碘,应该将它存放在________________。
药品柜 | 甲柜 | 乙柜 | 丙柜 | 丁柜 |
药品 | 乙醇、乙酸 | 活性炭、红磷 | 锌粒、铜片 | 氯化钠、氯化钾 |
A.甲柜 B.乙柜 C.丙柜 D. 丁柜
④“三酸(硫酸、盐酸、硝酸)”与“两碱(氢氧化钠、碳酸钠)”能发生反应。将一定量的稀硫酸逐滴滴入到氢氧化钠和碳酸钠的混合溶液中,边滴加边搅拌,直至有少量气泡产生,此过程中共发生的离子反应有_______个。
(2)含铁元素的物质有很多,在生产、生活中应用广泛。取少量某油漆的原料Fe2O3(红棕色粉末),加人适量浓盐酸,反应后得到棕黄色溶液,取少量棕黄色溶液置于试管中再滴入NaOH溶液,可观察到有沉淀生成,生成沉淀的离子方程式为_______________________________,另在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入2 mL上述棕黄色溶液,继续加热至液体呈_______色,停止加热,证明所得分散系类型的实验方法的名称是_____________________。