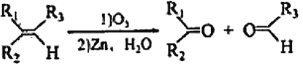题目内容
【题目】相同温度下,容积相同的3个恒温密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6KJ·mol-1
2NH3(g) ΔH=-92.6KJ·mol-1
实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | |||
N2 | H2 | NH3 | Ar | ||
① | 1 | 3 | 0 | 0 | 放出热量:Q1 |
② | 0.9 | 2.7 | 0.2 | 0 | 放出热量:Q2 |
③ | 0.9 | 2.7 | 0.2 | 0.1 | 放出热量:Q3 |
下列比较正确的是
A. 放出热量大小:Q1>Q2=Q3
B. 容器中的压强:③>①=②
C. N2的转化率:①<②<③
D. 平衡时NH3的体积分数:①=②<③
【答案】AB
【解析】A.②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于Q1,③中在②的基础上加入Ar气,容器体积不变,充入Ar对平衡无影响,所以Q2=Q3,所以Q1 >Q2 =Q3,故A正确;B.容器体积不变,①②③三平衡等效,③中充入了Ar气,压强较大,所以容器中压强③>①=②,故B正确;C.①②③三平衡等效,②③加入反应物相同且少于①,所以氮气的转化率①>②=③,故C错误;D.①②③三平衡等效,所以平衡时NH3的体积分数:①=②=③,故D错误;故选AB。

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目