题目内容
【题目】I.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是______(填序号,下同)。
2SO3(g)达到平衡状态的是______(填序号,下同)。
(2)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_______。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是_______。(注:B,C,D均为无色物质)
II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)反应开始至2min,以气体Y表示的平均反应速率为________;
(2)该反应的化学方程式为___________;
(3)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅲ.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。则电池工作时负极的电极反应式为________。

【答案】①③④ ②④ 0.05mol(/L·min) 3X+Y![]() 2Z 7:5 2NH3-6e-+6OH-=N2+6H2O
2Z 7:5 2NH3-6e-+6OH-=N2+6H2O
【解析】
I.(1)判断可逆反应达到平衡,主要有两个判据:一是正、逆反应速率相等,一是变量不变;
(2)注意该反应中物质A是固体;
II.(1)用好速率本义式进行计算;
(2)用好题图中的数据,算出各物质的变化量之比,进而求出化学计量数;
(3)用好“三段式”,求出a和b的物质的量,再求比值;
III.明确负极是通氨气的一极,用好题给的碱性介质。
I.(1)①恒温恒容时,反应物与生成物分子数不同,压强是个变量,压强不变说明反应达到平衡;
②气体密度始终不变,不能用作判断反应是否平衡的依据;
③混合气体总物质的量是个变量,总物质的量不变,说明该反应达到平衡;
④混合气体平均相对分子质量是个变量,平均相对分子质量不变,说明该反应达到平衡;
⑤混合气体始终无色,所以不能根据颜色判断该反应是否达到平衡;
综上所述选①③④;
(2)①注意A是固体,则混合气体压强始终不变;
②反应过程中有固体参与,则混合气体密度会发生改变,当密度不变时反应平衡;
③反应物与生成物中气体分子总数相同,则混合气体总物质的量始终不变;
④同②,有固体参与反应,则混合气体平均相对分子质量不变时反应平衡;
⑤B、C、D均为无色气体,则不能根据混合气体的颜色变化来判断反应是否平衡;
综上所述选②④;
II.(1)气体Y浓度从1mol/L变成0.9mol/L,用时2分钟,则平均反应速率为0.1mol/L÷2min=0.05 mol/(L·min);
(2)由图可得出反应物和生成物,且X、Y、Z的物质的量改变量之比为:3:1:2,所以各物质的化学计量数之比为3:1:2,则该反应方程式为:3X+Y![]() 2Z,注意标出反应可逆;
2Z,注意标出反应可逆;
(3)由题意设在该时刻各物质的量分别为n、n、![]() ,据此写出“三段式”进行
,据此写出“三段式”进行
3X+Y![]() 2Z
2Z
初始 a b 0
变化 a-n b-n ![]()
剩余 n n ![]()
据化学计量数有: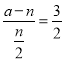 ,解得a=
,解得a=![]() ;同理
;同理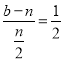 ,解得b=
,解得b=![]() ;则a:b=7:5;
;则a:b=7:5;
III.该装置是原电池,通入氨气的一极发生了氧化反应,为原电池的负极,考虑是KOH介质,所以负极的电极反应为:2NH3-6e-+6OH-=N2+6H2O。

 优加精卷系列答案
优加精卷系列答案【题目】下列实验操作或事实与预期实验目的或所得结论对应正确的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有Fe3+ |
B | 向AgNO3溶液中滴加过量氨水,溶液澄清 | Ag+与NH3H2O能大量共存 |
C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3显碱性 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于二元酸 |
A. A B. B C. C D. D
【题目】相同温度下,容积相同的3个恒温密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6KJ·mol-1
2NH3(g) ΔH=-92.6KJ·mol-1
实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | |||
N2 | H2 | NH3 | Ar | ||
① | 1 | 3 | 0 | 0 | 放出热量:Q1 |
② | 0.9 | 2.7 | 0.2 | 0 | 放出热量:Q2 |
③ | 0.9 | 2.7 | 0.2 | 0.1 | 放出热量:Q3 |
下列比较正确的是
A. 放出热量大小:Q1>Q2=Q3
B. 容器中的压强:③>①=②
C. N2的转化率:①<②<③
D. 平衡时NH3的体积分数:①=②<③