题目内容
【题目】工业上可用CO2和H2反应合成甲醇。
已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1= - 242kJ/mol
CH3OH(g)+3/2O2(g) =CO2(g)+2H2O(g) △H2= - 676kJ/mol
(1)写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。常温下,某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
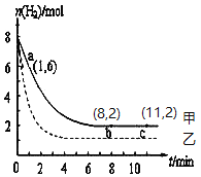
(2)该反应能在________(填“高温”或“低温”)条件下自发进行;从a点到b点,用H2表示该反应的平均化学反应速率是____________。(保留两位有效数字),a点逆反应速率_____b点逆反应速率(填“>”、“<”或“=”);达平衡时,CO2的转化率是_____。
(3)若仅改变某一实验条件再进行一次实验,测得H2的物质的量随时间变化如图中虚线(乙)所示,曲线(乙)对应改变的实验条件可以是________(填序号)。
a.加催化剂 b.增大压强 c.升高温度 d.增大H2浓度
(4)若曲线甲b点达到平衡时体系压强为100MPa,此时H2的平衡分压为_______MPa。(某物质分压=总压×某物质的物质的量分数)
(5)下列叙述能标志该反应达到化学平衡状态的是_________
a.CO2与H2的转化率之比不变 b.υ(生成H2) : υ(消耗H2O) = 3:1
c.混合气体的相对分子质量不变 d.甲醇与水蒸气的分压比不变
【答案】CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH= -50 kJ/mol 低温 0.28mol/(L·min) < 33.3% b 20 ac
【解析】
(1)根据盖斯定律对已知热化学方程式进行加合运算。
(2) 由CO2(g)+3H2(g)=CH3OH(g)+H2O(g) 的ΔH、ΔS的正负,再根据ΔH-TΔS<0时反应才能自发进行,确定该反应自发进行的温度条件。由图像分析,初始只投入了反应物,从正反应开始,第8min后反应已处于平衡状态,根据反应速率公式![]() =
=![]() 计算H2的平均反应速率。根据逆反应速率受生成物浓度影响分析a、b两点逆反应速率的相对大小。最后根据转化率概念计算CO2的转化率。
计算H2的平均反应速率。根据逆反应速率受生成物浓度影响分析a、b两点逆反应速率的相对大小。最后根据转化率概念计算CO2的转化率。
(3)从图像分析,再一次实验时起始投料不变,达到平衡所需要的时间缩短,平衡时H2的物质的量比甲曲线小,表明平衡向正反应方向移动。由此分析。
(4)根据相关数据先计算H2平衡时物质的量分数,再根据“某物质分压=总压×某物质的物质的量分数”得到H2的平衡分压。
(5)根据化学平衡状态的特征分析。
(1)给已知的热化学方程式编号①H2(g)+![]() O2(g)=H2O (g) △H1= - 242kJ/mol。②CH3OH(g)+
O2(g)=H2O (g) △H1= - 242kJ/mol。②CH3OH(g)+![]() O2(g) =CO2(g)+2H2O(g) △H2= - 676kJ/mol。根据盖斯定律,将①×3-②得:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=(- 242kJ/mol)×3-(- 676kJ/mol)= -50 kJ/mol。即所求的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50 kJ/mol。
O2(g) =CO2(g)+2H2O(g) △H2= - 676kJ/mol。根据盖斯定律,将①×3-②得:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=(- 242kJ/mol)×3-(- 676kJ/mol)= -50 kJ/mol。即所求的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50 kJ/mol。
(2) 由反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-50 kJ/mol可知,该反应ΔH<0,ΔS<0,因为只有当ΔH-TΔS<0时该反应才能自发进行,因此只有T值较小时(即低温)下才可能自发进行。由图像知从a点到b点过程中Δc(H2)=![]() -
-![]() =2mol/L,Δt=8min-1min=7min,则用H2表示该反应的平均反应速率
=2mol/L,Δt=8min-1min=7min,则用H2表示该反应的平均反应速率![]() =
=![]() =
=![]() =0.28mol/(L·min)。反应开始时生成物浓度为0,逆反应速率为最小,反应开始后生成物浓度逐渐增大,逆反应速率逐渐增大,所以a、b两点逆反应速率大小关系为:a<b。由图像可知b、c两点处于平衡状态,平衡时H2的物质的量为2mol,参加反应的H2的物质的量Δn(H2)=8mol-2mol=6mol,根据反应方程式计量数得CO2的转化量Δn(CO2)=
=0.28mol/(L·min)。反应开始时生成物浓度为0,逆反应速率为最小,反应开始后生成物浓度逐渐增大,逆反应速率逐渐增大,所以a、b两点逆反应速率大小关系为:a<b。由图像可知b、c两点处于平衡状态,平衡时H2的物质的量为2mol,参加反应的H2的物质的量Δn(H2)=8mol-2mol=6mol,根据反应方程式计量数得CO2的转化量Δn(CO2)=![]() ·Δn(H2)=
·Δn(H2)= ![]() ×6mol=2mol,所以达平衡时CO2的转化率=
×6mol=2mol,所以达平衡时CO2的转化率=![]() ×100%=
×100%=![]() ×100%=33.3%。
×100%=33.3%。
(3)分析图像可知,再一次实验的初始投料相同,达到平衡所用时间缩短,平衡向正反应方向移动。a.催化剂不会使平衡移动,a项错误;b.对于有气体参加的反应,增大压强,反应速率增大,平衡向气体体积减小的方向移动,所以增大压强,该反应达到平衡所用时间缩短,平衡向正反应方向移动,b项正确;c.升高温度平衡向吸热反应方向移动,即该反应向逆反应方向移动,c项错误;d.由图像知初始时H2的浓度没有变化,d项错误;答案选b。
(4)曲线甲的b点达到平衡时H2的物质的量为2mol,由“三段式”分析如下:
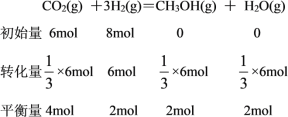
平衡时H2的物质的量分数=![]() ×100%=20%,则H2的平衡分压=100MPa×20%=20MPa。
×100%=20%,则H2的平衡分压=100MPa×20%=20MPa。
(5)a. 由反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)可知,反应过程中CO2和H2转化量之比=1:3,但初始时CO2和H2的物质的量之比=6mol:8mol=3:4≠1:3,因此反应过程中CO2和H2的转化率之比≠1:3,且一直在变化,只有达到平衡状态时CO2和H2的转化率之比才不变,所以CO2与H2的转化率之比不变,能标志该反应达到化学平衡状态,a项正确;b.υ(生成H2)表示逆反应速率,υ(消耗H2O)也表示逆反应速率,不能确定此时反应是否达到化学平衡状态。所以υ(生成H2) : υ(消耗H2O) = 3:1,不能标志该反应达到化学平衡状态,b项错误;c.根据质量守恒,反应过程中混合气体总质量(m总)不变,由反应方程式知,在反应过程中混合气体的总物质的量(n总)一直减小,根据混合气体的相对分子质量公式![]() =
=![]() 可推知,混合气体的相对分子质量在反应过程中一直在变化,只有达到平衡状态时才不变,所以混合气体的相对分子质量不变,能标志该反应达到化学平衡状态,c项正确;d.根据“某物质分压=总压×某物质的物质的量分数”可知,物质分压与对应组分的物质的量成正比,由反应方程式计量数知,生成甲醇与水蒸气的物质的量之比一直等于1:1,因此反应过程中甲醇与水蒸气的分压比一直不变,所以甲醇与水蒸气的分压比不变,不能标志该反应达到化学平衡状态,d项错误;答案选ac。
可推知,混合气体的相对分子质量在反应过程中一直在变化,只有达到平衡状态时才不变,所以混合气体的相对分子质量不变,能标志该反应达到化学平衡状态,c项正确;d.根据“某物质分压=总压×某物质的物质的量分数”可知,物质分压与对应组分的物质的量成正比,由反应方程式计量数知,生成甲醇与水蒸气的物质的量之比一直等于1:1,因此反应过程中甲醇与水蒸气的分压比一直不变,所以甲醇与水蒸气的分压比不变,不能标志该反应达到化学平衡状态,d项错误;答案选ac。