题目内容
【题目】Fritz Haber在合成氨领域的贡献距今已经110周年,氮族元素及其化合物应用广泛。
(1)在基态13N原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是________,与NO3-互为等电子体的分子为__________。液氨中存在电离平衡2NH3![]() NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
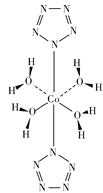
(3)我国科学工作者实现世界首次全氮阴离子(N5-)金属盐Co(N5)2(H2O)4·4H2O的合成,其结构如图所示,可知N5-的化学键类型有______________。
(4)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的化学式为__________,其晶体密度为__________(设阿伏加德罗常数的值为NA,列出计算式)g·cm-3。
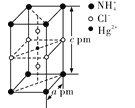
【答案】2 哑铃(纺锤) NH3 SO3或BF3 V形 sp3 液氨存在分子间氢键,沸点高于PH3,故NH3比PH3更易液化 σ键、π键 HgNH4Cl3 1×325.5/NA×(a×10-10)2×c×10-10
【解析】
(1)氮原子的电子排布是1s22s22p3,可知核外存在2对自旋相反的电子。核外电子占据的最高能级为2p,电子云轮廓图为哑铃(纺锤)形;
(2) NH3、NO3-、NO2-中,中心原子价层电子对数分别为3、4、4,不同于其他两种粒子的是NH3;等电子体要求原子总数相同、价原子总数相同,与NO3-互为等电子体的分子为SO3或BF3;NH![]() 的中心原子N的价层电子对数为4,孤电子对数为2,可知空间构型为V形;氨气分子中氮原子价层电子对个数=3+
的中心原子N的价层电子对数为4,孤电子对数为2,可知空间构型为V形;氨气分子中氮原子价层电子对个数=3+![]() ×(5-3×1)=4,所以N原子采用sp3杂化;液氨存在分子间氢键,沸点高于PH3,故NH3比PH3更易液化;
×(5-3×1)=4,所以N原子采用sp3杂化;液氨存在分子间氢键,沸点高于PH3,故NH3比PH3更易液化;
(3)由结构可知,存在的化学键为σ键、π键;
(4)由均摊法可知,1个晶胞中Hg2+、NH![]() 、Cl-个数分别为1、1、3,则晶体X的化学式为HgNH4Cl3;
、Cl-个数分别为1、1、3,则晶体X的化学式为HgNH4Cl3;
晶体密度ρ=N M/NAV,又M(HgNH4Cl3)=325.5 g/mol,V=(a×10-10)2·c×10-10 cm3。
故ρ=1×325.5/NA×(a×10-10)2×c×10-10g·cm-3。