题目内容
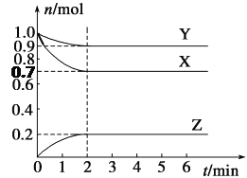
【题目】(1)物质X的产量通常用来衡量一个国家的石油化工水平。以X为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。

(1)X所含官能团的名称是______________,A物质所含官能团的名称是________。
(2)反应③的化学方程式是_______________,以乙烯为原料可合成有机高分子化合物D,反应①的化学方程式是____________________,该反应属于______反应(填有机反应类型)。
(3)下列物质中,不能通过乙烯加成反应得到的是________(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
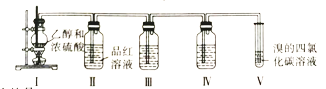
(4)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是______。
②实验开始时,试管b中的导管不伸入液面下的原因是______。
③反应结束后,将试管b中的混合液经过____(填写实验分离操作)可得到纯净的乙酸乙酯。
【答案】碳碳双键 羟基 2CH3CH2OH+O2![]() 2CH3CHO+2H2O nCH2=CH2
2CH3CHO+2H2O nCH2=CH2![]()
![]() 加聚 b CH3COOH+C2H5OH
加聚 b CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 防止溶液倒吸 分液、蒸馏
CH3COOC2H5+H2O 防止溶液倒吸 分液、蒸馏
【解析】
乙烯产量是衡量一个国家的石油化工水平的标志,所以X是乙烯,乙烯含有碳碳双键,能发生加聚反应,生成聚乙烯,所以D是聚乙烯。乙烯也能和水发生加成反应生成乙醇,则A是乙醇。乙醇发生氧化反应生成B,所以B是乙醛。乙醛氧化生成乙酸。
(1)乙烯结构式为:CH2=CH2,含有碳碳双键,A为乙醇,结构式为:CH3CH2OH,含有羟基,故答案为:碳碳双键;羟基;
(2)反应③是乙醇的催化氧化生成乙醛,反应的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应①是乙烯的加聚反应,反应的化学方程式是nCH2=CH2
2CH3CHO+2H2O,反应①是乙烯的加聚反应,反应的化学方程式是nCH2=CH2![]()
![]() ,该反应是加聚反应,故答案为:2CH3CH2OH+O2
,该反应是加聚反应,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;nCH2=CH2
2CH3CHO+2H2O;nCH2=CH2![]()
![]() ;加聚;
;加聚;
(3)a.乙烯含有碳碳双键,和氢气发生加成反应生成乙烷,故不选a;
b.选项b中的有机物两个氯原子连在同一个碳原子上,不可能利用乙烯发生加成反应得到,故选b;
c.和溴化氢发生加成反应生成溴乙烷,故不选c。
故本题答案为b。
(4)①在浓硫酸催化作用下,乙醇和乙酸发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②因乙醇和乙酸都是和水互溶,如果直接插入水中,容易引起倒吸,所以试管b中的导管不伸入液面下的作用是防止溶液倒吸,故本题答案为:防止溶液倒吸;
③乙酸乙酯不溶于碳酸钠溶液,可采用分液的方法除去碳酸钠溶液,但乙酸乙酯会溶解部分挥发出的乙醇等杂质,还需采用蒸馏的方法提纯,故本题答案为:分液、蒸馏。

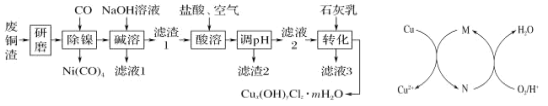
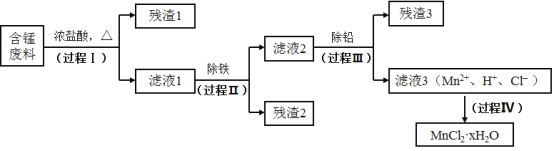
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程:
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是_____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,_____________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:_____________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②补全ⅱ中的操作:_____________。
③两种方法比较,氨水法除铁的缺点是_____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是_____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=_____________。
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式__________
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称"同系物"),它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为____;其化学方程式为__________