题目内容
【题目】(1)向0.01 mol/L的NH4Cl溶液中分别加入少量的KOH固体、浓盐酸、FeCl3固体、Na2CO3固体,使NH4+水解平衡移动的方向分别为_____、_____、_____、____(填“右”“左”或“不移动”)
(2)写出Na2CO3溶液中的三大守恒规律
电荷守恒:_____________________;
物料守恒:_____________________;
质子守恒:_____________________。
【答案】右 左 左 右 c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
【解析】
(1)NH4Cl在溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+,根据加入的电解质电离产生的微粒与该平衡微粒的关系分析其对水解平衡移动的影响;
NH3·H2O+H+,根据加入的电解质电离产生的微粒与该平衡微粒的关系分析其对水解平衡移动的影响;
(2)电荷守恒就是溶液中所有阳离子带有的正电荷总数与所有阴离子带有的负电荷总数相等;
物料守恒就是溶液中Na+的总数为所有含C元素的微粒的总数的2倍;
质子守恒就是水电离产生的H+与OH-数目相等。
(1)NH4Cl在溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
加入少量的KOH固体,KOH电离产生OH-,会消耗NH4+水解产生的H+,使溶液中c(H+)减小,水解平衡正向移动,对NH4+水解平衡起促进作用,水解平衡向右移动;
加入少量浓盐酸,盐酸电离产生H+,使溶液中c(H+)增大,对该平衡起抑制作用,水解平衡向左移动;
加入少量FeCl3固体,该盐是强酸弱碱盐,Fe3+水解产生H+,使溶液中c(H+)增大,水解平衡向左移动;
由于Na2CO3是强碱弱酸盐,CO32-水解消耗水电离产生的H+,使溶液显碱性,所以加入少量Na2CO3固体,相当于向溶液中加入了少量的碱,溶液中的OH-会消耗NH4+水解产生的H+,使水解平衡正向移动,即水解平衡向右移动;
(2) Na2CO3溶液中阳离子有Na+、H+,阴离子有CO32-、HCO3-、OH-,由于溶液显中性,说明溶液中阳离子带有的正电荷总数与所有阴离子带有的负电荷总数相等,所以有关系式:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);
根据化学式Na2CO3的电离方程式Na2CO3=2Na++CO32-可知:Na+的数目是CO32-的2倍,CO32-在溶液的存在形式有CO32-、HCO3-、H2CO3,因此有关系式:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);
在任何物质的水溶液中水电离产生的H+与OH-数目相等。Na2CO3是强碱弱酸盐,在溶液中CO32-水解时溶液显碱性,所有溶液中c(OH-)=c(H+)剩余+ c(H+)消耗= c(H+)+c(HCO3-)+2c(H2CO3),这个式子就是Na2CO3溶液中的质子守恒式。

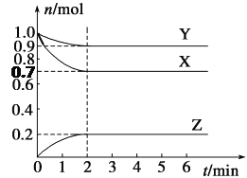
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程:
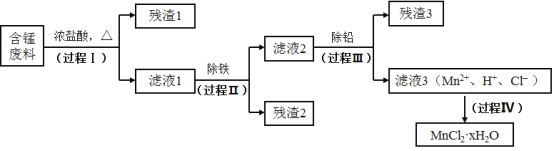
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是_____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,_____________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:_____________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②补全ⅱ中的操作:_____________。
③两种方法比较,氨水法除铁的缺点是_____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是_____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=_____________。
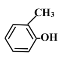
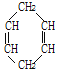
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式__________
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称"同系物"),它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为____;其化学方程式为__________