题目内容
【题目】298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是( )
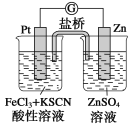
A.该原电池的正极反应是Zn-2e-=Zn2+
B.左侧烧杯中溶液的血红色逐渐褪去
C.该电池铂电极上有气泡出现
D.该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+
【答案】B
【解析】
试题分析:A、电极总反应是Zn+2Fe3+=Zn2++2Fe2+,根据原电池的工作原理,锌的化合价升高,锌作负极,故错误;B、根据选项A的分析,消耗Fe3+,红色变浅,故正确;C、Pt作正极,电极反应式为Fe3++e-=Fe2+,因此无气泡冒出,故错误;D、根据信息,Fe3+被还原成Fe2+,故错误。

练习册系列答案
相关题目
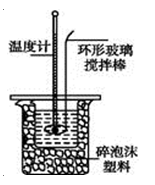
【题目】用100mL 1.00mol·L-1盐酸与100mL 1.10mol·L-1NaOH溶液在如下图所示的装置中进行中和热测定实验。以下是四次实验所得数据。回答下列问题:
实验 数据 | 盐酸起始温度t1/℃ | 氢氧化钠起始温度t2/℃ | 两溶液混合后 温度t3/℃ |
1 | 21.0 | 21.1 | 26.9 |
2 | 21.5 | 21.7 | 28.2 |
3 | 21.9 | 22.1 | 28.7 |
4 | 22.3 | 22.5 | 29.2 |
(1)上表中的温度差平均值为 ℃
(2)近似认为上述两种溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则计算得到中和热ΔH= (取小数点后一位)。
(3)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用环形铜质搅拌棒代替环形玻璃搅拌棒
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸溶液起始温度后直接测定NaOH溶液的温度