题目内容
【题目】用100mL 1.00mol·L-1盐酸与100mL 1.10mol·L-1NaOH溶液在如下图所示的装置中进行中和热测定实验。以下是四次实验所得数据。回答下列问题:
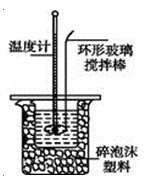
实验 数据 | 盐酸起始温度t1/℃ | 氢氧化钠起始温度t2/℃ | 两溶液混合后 温度t3/℃ |
1 | 21.0 | 21.1 | 26.9 |
2 | 21.5 | 21.7 | 28.2 |
3 | 21.9 | 22.1 | 28.7 |
4 | 22.3 | 22.5 | 29.2 |
(1)上表中的温度差平均值为 ℃
(2)近似认为上述两种溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则计算得到中和热ΔH= (取小数点后一位)。
(3)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用环形铜质搅拌棒代替环形玻璃搅拌棒
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸溶液起始温度后直接测定NaOH溶液的温度
【答案】(1)6.7;(2)-56.0kJ/mol;(3)a、b、c、d。
【解析】
试题分析:(1)第一组数值与其他数值相差较大,因此第一组数值忽略不计,第2组中盐酸和氢氧化钠平均温度为21.6℃,两溶液混合后的温度与混合前的温度差为(28.2-21.6) =6.6℃,第三组混合前的平均温度是22.0℃,混合后和混合前的温差是6.7℃,第四组混合前的平均温度为22.4℃,混合后的温度和混合前的温度差为(29.2-22.4)=6.8℃,因此平均温度差为6.7℃;(2)根据△H=-cm△t/n(H2O)=-4.18×10-3×200×6.7/(100 × 10-3 × 1) kJ·mol-1 = -56.0 kJ·mol-1;(3)a、根据(2)计算出的中和热小于57.3,造成热量的损失,实验装置保温、隔热效果差,造成热量损失,热量减小,故正确;b、铜导热效果好,造成热量的损失,故正确;c、多次把NaOH溶液倒入盛有盐酸的小烧杯中,造成热量损失,故正确;d、发生中和反应,造成温度升高,温差减小,故正确。

【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:
③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为:
| ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为:
|
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:__________________;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2。当n =________时,这类有机物开始有同分异构体。
(3)B的分子式为____________,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:___ ;
(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:_____________。