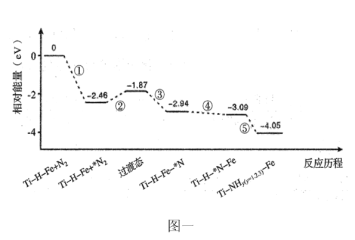
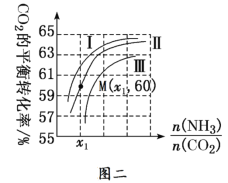
题目内容
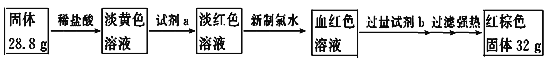
【题目】高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,实验室制取高铁酸钠的化学方程式如下 :
(1)请用双线桥法表达出此反应的电子转移情况:__________
2Fe( NO3 )3+16NaOH+3Cl2=2Na2FeO4+6NaNO3 +6NaCl+8H2O
(2)若要制取8.3g高铁酸钠需要标准下Cl2的体积为多少?______若所用氢氧化钠溶液体积为200mL,则氢氧化钠溶液的物质的量浓度是多少?(写出计算过程)_______
【答案】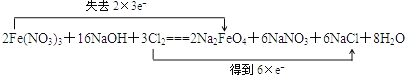 1.68L 2mol/L
1.68L 2mol/L
【解析】
(1)该反应中Fe元素化合价由+3价变为+6价,Cl元素化合价由0价变为-1价;
失电子化合价升高的元素被氧化,得电子化合价降低的反应物是氧化剂;
(2)根据氯气和高铁酸钠的关系式计算消耗氯气的物质的量,算出标况下的体积,再根据高铁酸钠和氢氧化钠的关系式求出氢氧化钠的物质的量,求出c=![]() ;
;
(1)该反应中Fe元素化合价由+3价变为+6价,Cl元素化合价由0价变为1价,转移电子总数为6, ,
,
故答案为: ;
;
(2)设消耗氯气气体体积为x L,NaOH的物质的量为y mol;根据化学反应方程求解:
2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O
16mol 3mol×22.4L/mol 2mol × 166g/mol
y x 8.3g
x =![]() =1.68L
=1.68L
y=![]() =0.4mol c=
=0.4mol c=![]() =
=![]() =2mol/L
=2mol/L
故答案为:1.68L;2mol/L。

【题目】根据下表中实验操作、现象得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向饱和Na2CO3溶液中加入BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸 | 产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
B | 向FeCl3溶液中滴加NaI溶液,然后滴加CCl4,振荡并静止 | 有机层出现紫 红色 | 氧化性:Fe3+>I2 |
C | 向Na2CO3溶液中滴加盐酸,将产生的气体通入硅酸钠溶液 | 溶液中出现白色沉淀 | 非金属性:Cl>C>Si |
D | 将碳与浓硫酸共热产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D
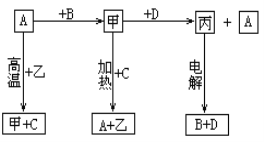
【题目】利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠,实现清洁化工生产,工艺流程如图:
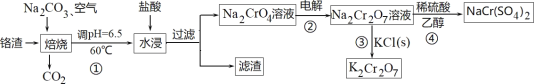
回答下列问题:
(1)焙烧 Cr2O3 转化为Na2CrO4 的化学反应方程式是_____;
(2)实验室模拟此工业流程①,控制反应温度 60℃的方法是_____;
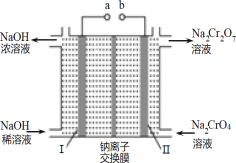
(3)流程②用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,其原理如图所示,a 是_____极;电极Ⅱ的电极反应式是_____;当生成 2mol Na2Cr2O7时,电路中转移的电子_____mol;
(4)由下图和下表中的溶解度变化,流程③制备 K2Cr2O7,应先充分加热,然后_____反应才能顺利进行;

重铬酸钠的溶解度表:
温度℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度% | 61.6 | 62.8 | 65.1 | 71.8 | 78.7 | 81.1 |
(5)为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,应再进行_____操作;
(6)流程④Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为_____(写一种即可)。
【题目】乙酰苯胺(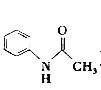 )在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(
)在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等,可通过苯胺(![]() )和乙酸酐(
)和乙酸酐(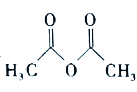 )反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为
)反应制得。已知:纯乙酰苯胺是白色片状晶体,相对分子质量为135,熔点为![]() ,易溶于有机溶剂。在水中的溶解度如下。
,易溶于有机溶剂。在水中的溶解度如下。
温度/℃ | 20 | 25 | 50 | 80 | 100 |
溶解度/( | 0.46 | 0.56 | 0.84 | 3.45 | 5.5 |
实验室制备乙酰苯胺的步骤如下(部分装置省略):
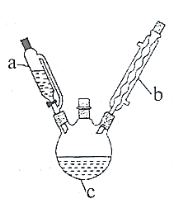
Ⅰ.粗乙酰苯胺的制备。将![]() 乙酸酐放入三口烧瓶
乙酸酐放入三口烧瓶![]() 中,在
中,在![]() 中放入
中放入![]() 新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流
新制得的苯胺。将苯胺在室温下逐滴滴加到三口烧瓶中。苯胺滴加完毕,在石棉网上用小火加热回流![]() ,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有
,使之充分反应。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有![]() 冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用______洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用______洗涤晶体2-3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯。将上述制得的粗乙酰苯胺固体移入![]() 烧杯中,加入
烧杯中,加入![]() 热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸
热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸![]() ,趁热过滤。待滤液冷却至室温,有晶体析出,______、______,干燥后称量产品为
,趁热过滤。待滤液冷却至室温,有晶体析出,______、______,干燥后称量产品为![]() 。
。
回答下列问题:
(1)仪器![]() 的名称是______________。
的名称是______________。
(2)写出制备乙酰苯胺的化学方程式______________。
(3)步聚I中,减压过滤的优点是_____;用滤液而不用蒸馏水冲洗烧杯的原因是_________;洗涤晶体最好选用________(填字母)。
A.乙醇 B.![]() C.冷水 D.乙醚
C.冷水 D.乙醚
(4)步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是______________。
(5)步骤Ⅱ中,干燥前的操作是______________。上述提纯乙酰苯胺的方法叫_____________。
(6)乙酰苯胺的产率为______________。(计算结果保留3位有效数字)