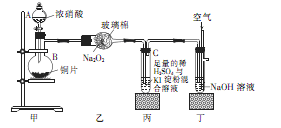
题目内容
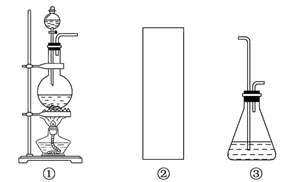
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。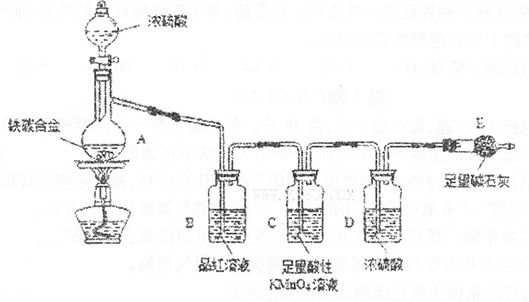
I.测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根
导管,然后________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。铁碳合金中铁的质量分数为_____________________________________________(写表达式)。
(3)装置C中反应的离子方程式为________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是____________________________________.
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分
数也可能会偏离。你认为其中的原因是_________________________________________。
Ⅱ.探究浓硫酸的某些性质:
(6)往A中滴加足量的滚硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
_____________________________________________________________________。
(7)将A中固体换为金属铜则与浓硫酸发生反应的化学方程式是__________________
_______________________,反应中浓硫酸表现出的性质是______________________。
(1)把导管放入盛水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管口产生一段稳定的水柱。(2分)
(2)(11a-3b)/11a×100℅(2分)
(3)2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+(2分)
(4)在装置E的后边再连接一个与E相同的装置。(2分)
(5)反应产生的CO2气体未能完全排到装置E中,导致b偏低。
(6)常温下,铁被浓硫酸钝化,碳不与浓硫酸反应。(2分)
(7) 2H2SO4(浓)+Cu CuSO2+ SO2↑+2H2O; (2分) 酸性和强氧化性(2分)
CuSO2+ SO2↑+2H2O; (2分) 酸性和强氧化性(2分)
解析试题分析:(1)用微热法检验密封装置的气密性。
(2)E增重bg,是CO2的质量,可以计算碳的质量3b/11g,铁的质量 (a-3b/11)g, 铁的质量分数为(11a-3b)/11a×100℅.
(3)装置C中是K MnO4溶液,有强氧化性,能和有还原性的SO2反应,离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。
(4)为防止空气中CO2、H2O进入E管,可以在E的后边再连接一个与E相同的装置,吸收空气中CO2、H2O。
(5)反应结束后,装置内还有生成的气体残留。
(6) 常温下,铁被浓硫酸钝化,碳不与浓硫酸反应。
(7) 铜与浓硫酸加热的条件下发生反应,生成CuSO2和 SO2。
考点:浓硫酸的性质;通过实验来测定物质的纯度。

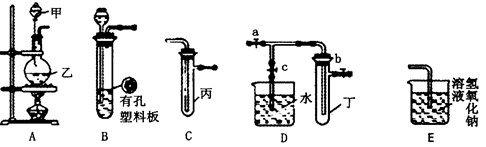
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。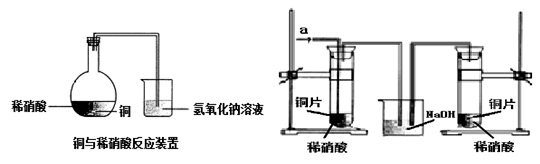
图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。