题目内容
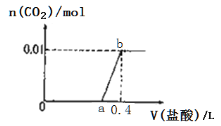
【题目】Ⅰ.实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液,为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00mL甲溶液,向其中缓慢滴加乙溶液15.00mL,共收集到224mL(标准状况)气体
②量取15.00mL乙溶液,向其中缓慢滴加甲溶液25.00mL,共收集到112mL(标准状况)气体
(1)判断:甲是___溶液,其物质的量浓度为___mol/L;
(2)实验②中所发生反应的离子方程式为___。
Ⅱ.将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好能被500mL2.0mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,请计算出NaNO3的物质的量___(要求有计算过程与步骤)。
【答案】HCl 0.8 CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑ 0.2mol
【解析】
I.往碳酸钠溶液中逐滴加入盐酸,发生反应为:Na2CO3+HCl(少量)=NaCl+ NaHCO3,NaHCO3+HCl=NaCl+H2O+CO2↑
往盐酸溶液中逐滴加入碳酸钠,发生反应为:Na2CO3+2HCl(过量)=2NaCl+H2O+CO2↑
从上面方程式可以看出,若盐酸的用量不足,则后一种情况产生的CO2气体多。
II.用得失电子守恒和原子守恒计算。
I.①量取25.00mL甲溶液,向其中缓慢滴加乙溶液15.00mL,共收集到224mL(标准状况)气体
②量取15.00mL乙溶液,向其中缓慢滴加甲溶液25.00mL,共收集到112mL(标准状况)气体
(1)①中产生的气体比②多,结合前面分析,可判断:甲是HCl溶液。答案为:HCl
利用①,25.00mL甲溶液完全反应,可产生224mL(标准状况)CO2气体
224mL(标准状况)气体为0.01mol,则c(HCl)=![]()
答案为:0.8
(2)实验②中所发生反应的离子方程式为CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑。
答案为:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑
Ⅱ. 设反应生成NaNO2的物质的量为x
根据电子守恒,建立如下关系式:
Cu ~ NaNO2
64g 1mol
51.2g x
![]() =
=![]() ,解得x=0.8mol
,解得x=0.8mol
依据Na+守恒,n(NaNO3)= 0.500L×2.0mol/L-0.8mol=0.2mol
答案为:0.2mol

【题目】(1)在2L密闭容器中,起始投入4 molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
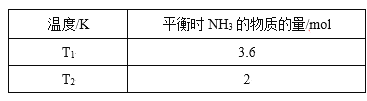
①则K1______K2,(填“>”、“<”或“=”)原因:_______。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1 mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A.3v(H2)正=2v(NH3)逆 B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态 D.△H保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 430 | 936 | 390 |
热化学方程式:__________。
(3)下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:
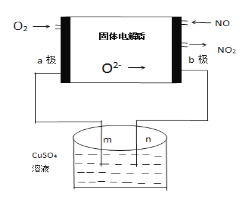
①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的PH为______。
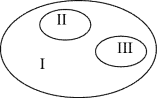
【题目】用圆表示 3 种物质之间的关系(见如图),其中Ⅰ为大圆,Ⅱ和Ⅲ是包含在大圆之内 的 2 个小圆。符合其关系的是( )
Ⅰ | Ⅱ | Ⅲ | |
A | 脱氧核糖核酸 | 核糖核酸 | 核酸 |
B | 染色体 | DNA | 脱氧核糖 |
C | 固醇 | 胆固醇 | 维生素 D |
D | 蛋白质 | 酶 | 性激素 |
A.AB.BC.CD.D