题目内容
某探究小组采用下图所示装置进行Fe粉与水蒸气的反应。
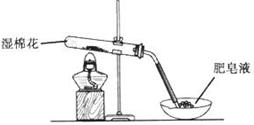
(1)实验前检查装置气密性的方法为________________________________________________________。
(2)检验实验中生成气体的实验操作是_____________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因是 ;验证方法为 。

(1)实验前检查装置气密性的方法为________________________________________________________。
(2)检验实验中生成气体的实验操作是_____________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因是 ;验证方法为 。
(1)将装置末端的导管插入盛有水的水槽中,双手捂住试管,导管口有气泡冒出,松开双手,导管内有一段水柱,则装置气密性良好;(2)点燃肥皂泡,有爆鸣声 (3)①FeO②Fe3O4+8H+=2Fe3++ Fe2+ +4H2O ③氯气将Fe2+氧化成Fe3+,Fe3+与SCN-反应溶液呈红色 SCN-被过量氯气氧化 ;向溶液中再加入KSCN溶液,溶液呈红色则说明之前SCN-被过量氯气氧化。
试题分析:(1)实验前检查装置气密性的方法为:将装置末端的导管插入盛有水的水槽中,双手捂住试管,导管口有气泡冒出,松开双手,导管内有一段水柱,则装置气密性良好;(2)实验所得的气体为氢气,检验氢气的实验操作是点燃肥皂泡,有爆鸣声;(3)实验所得的物质为FeO或Fe3O4,由于像乙实验所得的溶液中滴加KSCN溶液,无现象,故乙实验中所得的物质为FeO,甲实验中所得的物质为Fe3O4,故①乙组得到的黑色粉末是FeO②Fe3O4与稀盐酸反应的化学方程式为:Fe3O4+8H+=2Fe3++ Fe2+ +4H2O;③乙组步骤4中,溶液变红的原因为氯气将Fe2+氧化成Fe3+,Fe3+与SCN-反应溶液呈红色 ;SCN-被过量氯气氧化;向溶液中再加入KSCN溶液,溶液呈红色则说明之前SCN-被过量氯气氧化。

练习册系列答案
相关题目