题目内容
【题目】一种磁性材料的磨削废料(含镍质量分数约21%) 主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制各纯度较高的氢氧化镍,工艺流程如下: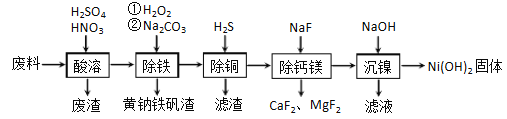
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成.写出金属镍溶解的离子方程式________________________________________。
(2)“除铁”时H2O2的作用是____________,为了证明添加的H2O2已足量,应选择的试剂是_____________(用化学式表示)溶液。黄钠铁矾[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,此步骤加入碳酸钠的目的是_________________________。
(3)“除铜”时,反应的离子方程式为_________________________,若用Na2S代替H2S除铜,优点是_________________________。
(4)已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_________________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程中Ni(OH)2 生成时,调节pH 约为________Ni2+刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,认为该离子沉淀完全: lg2=0.30)。
【答案】 5Ni+12H++2NO3-=5Ni2++N2↑+6H2O 将亚铁离子氧化为铁离子 K3[Fe(CN)6] 提高溶液的碱性,使黄钠铁矾形成析出 H2S+Cu2+=CuS↓+2H+ 无易挥发的有毒气体硫化氢污染环境 过量的F离子生成氢氟酸会腐蚀陶瓷容器 9.1或9.2(或9.1~9.2之间)
【解析】(1)镍在非氧化性酸中不溶,在氧化性酸(如硝酸)能够把金属镍溶解,反应的离子方程式为:5Ni+12H++2NO3-=5Ni2++N2↑+6H2O;正确答案:5Ni+12H++2NO3-=5Ni2++N2↑+6H2O。
(2)利用双氧水的氧化性,将亚铁离子氧化为铁离子;H2O2已足量时,溶液中没有亚铁离子了,加入K3[Fe(CN)6]溶液,没有蓝色沉淀,证明H2O2过量;碳酸钠溶液水解显碱性,加入碳酸钠的目的提高溶液的碱性,使黄钠铁矾形成析出;正确答案:将亚铁离子氧化为铁离子 ; K3[Fe(CN)6] ; 提高溶液的碱性,使黄钠铁矾形成析出。
(3)“除铜”时,铜离子与硫化氢反应生成硫化铜沉淀,反应的离子方程式为H2S+Cu2+=CuS↓+2H+;若用Na2S代替H2S除铜,优点是无易挥发的有毒气体硫化氢污染环境;正确答案:H2S+Cu2+=CuS↓+2H+;无易挥发的有毒气体硫化氢污染环境。
(4)NaF溶液水解产生少量氢氟酸,当NaF溶液用量太大时,氢氟酸的量增多,氢氟酸能够与陶瓷容器中二氧化硅反应而使陶瓷容器被腐蚀,正确答案:过量的F-离子生成氢氟酸会腐蚀陶瓷容器。
(5)Ksp[Ni(OH)2]=c(Ni2+)×c2(OH-)=2.0×10-15,当c(Ni2+)=1×10-5mol·L-1,c2(OH-)=2×10-10,c(OH-)=1.4×10-5,c(H+)=1/1.4×10-9, pH=9.1,正确答案:9.1或9.2(或9.1~9.2之间)。







