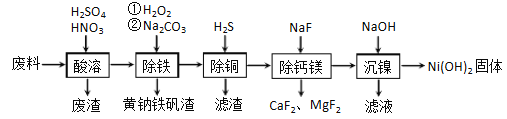
题目内容
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:
(已知碳酸氢铵受热分解后无固体剩余)

请根据操作流程回答下列问题:
(1)操作①在加热时应选择用_____________来盛装混合物(填仪器名称)。
(2)操作②发生的化学反应方程式为:___________________________________________;
判断SO42-已沉淀完全的方法是______________________________________________。
(3)操作③的目的是___________________________________。
(4)操作④和操作⑥的分离提纯方法的名称分别是____________、_____________。
【答案】坩埚(或硬质玻璃管)BaCl2+ Na2SO4 = BaSO4↓ + 2NaCl取上层清液少许于洁净试管中,滴加BaCl2溶液,若不变浑浊,则证明SO42-已沉淀完全除尽过量的BaCl2过滤蒸发结晶
【解析】
(1)操作①对固体进行加热,在加热时应选择用坩埚或硬质玻璃管来盛装混合物;
(2)加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,反应的化学方程式为BaCl2+ Na2SO4 = BaSO4↓ + 2NaCl;加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,故答案为:取上层清液少许于洁净试管中,滴加BaCl2溶液,若不变浑浊,则证明SO42-已沉淀完全;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;先过滤而后加碳酸钠溶液,在加入碳酸钠溶液后生成的碳酸钡还需要过滤,故答案为:除去过量的BaCl2;
(4)操作④将混浊液进行过滤;操作⑥为氯化钠溶液蒸发结晶得到氯化钠晶体;故答案为过滤、蒸发结晶。

【题目】有关键能数据如表
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2 kJ·mol-1,则表中x的值为 ( )
A.460B.920
C.1165.2D.423.3