题目内容
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效、安全的消毒剂。实验室以NH4Cl、盐酸和NaClO2(亚氯酸钠)为原料制备ClO2的流程如图所示。

请回答下列问题:
(1)ClO2中Cl的化合价是________________________。
(2)写出电解时发生反应的化学方程式:____________________________。
(3)NCl3与NaClO2(亚氯酸钠)反应的化学方程式NCl3+3H2O+6NaC1O2=6ClO2↑+3NaCl+3NaOH+NH3↑,该反应的氧化剂与还原剂的物质的量之比为______;若产生11.2L(标准状况)NH3,则转移电子的总数为___NA。
(4)二氧化氯进行水处理时,除了杀菌消毒外,还能除去水中的Fe3+和Mn2+,写出C1O2将Mn2+氧化为MnO2的离子方程式(C1O2反应后的产物为Cl-):_________________。
【答案】 +4 NH4Cl+2HCl![]() 3H2↑+NCl3 1:6 3 5Mn2++2ClO2+6H2O==5MnO2↓+2Cl-+12H+
3H2↑+NCl3 1:6 3 5Mn2++2ClO2+6H2O==5MnO2↓+2Cl-+12H+
【解析】分析:由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl![]() 3H2↑+NCl3,在NCl3溶液中加入NaClO2发生氧化还原反应,可生成混合气体ClO2和NH3,据此解答。
3H2↑+NCl3,在NCl3溶液中加入NaClO2发生氧化还原反应,可生成混合气体ClO2和NH3,据此解答。
详解:(1)ClO2中氧元素-2价,化合物中化合价代数和为0,则氯元素为+4价;
(2)根据以上分析可知电解时发生反应的化学方程式NH4Cl+2HCl![]() 3H2↑+NCl3;
3H2↑+NCl3;
(3)NCl3与NaClO2(亚氯酸钠)反应的化学方程式为NCl3+3H2O+6NaC1O2=6ClO2↑+3NaCl+3NaOH+NH3↑,该反应中NaClO2中氯元素由+3价升高到ClO2中的+4价,失1个电子,作还原剂,NCl3中的氮元素由+3价生成氨气中的-3价,得电子,作氧化剂,生成1mol氨气转移电子数为6mol,根据电子得失守恒可知该反应的氧化剂与还原剂的物质的量之比为1:6。11.2L氨气的物质的量是0.5mol,转移电子0.5mol×6=3mol,因此产生11.2L(标准状况)NH3,转移电子的总数为3NA;
(4)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为Cl-,因此该反应的离子方程式为5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+。

 习题精选系列答案
习题精选系列答案【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
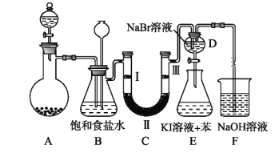
(1) 制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。
装置B中饱和食盐水的作用是___________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象____________________________________。
(2) 装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入__________。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3) 设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,离子反应方程为:_______________________,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是__________________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:_____________。
