题目内容
【题目】碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:

(1)试剂1最好选用_________。
a.Fe2O3 b.CaCO3 c.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式________________。
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在________。

(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克⑤称量生成CuO的质量为8.0g。计算出碱式碳酸铜的组成,写出计算过程。____________________________。
【答案】c 6Na2CO3+3Fe2(SO4)3+6H2O===2NaFe3(OH)6(SO4)2+6CO2 +5Na2SO4 8.5或填8.5左右的值 由题中测出生成CO2的质量为2.2克;测出生成水蒸气的质量为1.8克;称量生成CuO的质量为8.0克,可知CO2的物质的量为2.2g÷44g/mol =0.05mol;水的物质的量为1.8g÷18g/mol =0.1mol;生成CuO的物质的量为8.0g÷80g/mol =0.1mol,根据原子守恒可知,碳、氢、铜的原子数目比为C:H:Cu=x:(2y+2z):(x+y)=0.05:0.2:0.1,解得x:y:z=1:1:1,即样品的组成为:CuCO3·Cu(OH)2·H2O。
【解析】
电子工业中刻蚀线路板的酸性废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)中加入CuO(或氢氧化铜、碳酸铜等)调节pH是铁离子转化为氢氧化铁沉淀,过滤除去沉淀,在滤液中加碳酸钠,生成碱式碳酸铜,过滤得到碱式碳酸铜固体。
(1)氧化铜和稀硫酸反应生成硫酸铜和水;
(2)Fe2(SO4)3与Na2CO3反应,产生的气体为CO2,同时生成NaFe3(OH)6(SO4)2沉淀,根据质量守恒定律,即反应前后元素种类不变,原子种类、总个数和质量都不变,可写出此反应的化学方程式;
(3)根据图中提供的信息可以判断相关方面的问题;
(4)依据质量守恒定律可知样品的总质量等于二氧化碳、氧化铜及水的质量和,借助原子守恒通过计算可计算出x、y、z的比值,确定碱式碳酸铜的组成。
(1)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用氧化铜,这是因为氧化铜能够除去硫酸,不带入新的杂质,故选c,故答案为:c。
(2)根据质量守恒定律,反应的化学方程式为:6Na2CO3+3Fe2(SO4)3+6H2O===2NaFe3(OH)6(SO4)2+6CO2 +5Na2SO4,故答案为:6Na2CO3+3Fe2(SO4)3+6H2O===2NaFe3(OH)6(SO4)2+6CO2 +5Na2SO4。
(3)由图3所示可知,溶液pH为8.5左右时,硫酸根离子含量最低,溶液中铜离子沉淀效率最高,因此第二次沉淀时溶液pH最好控制在8.5,
故答案为:8.5。
(4)由题中测出生成CO2的质量为2.2克;测出生成水蒸气的质量为1.8克;称量生成CuO的质量为8.0克,可知CO2的物质的量为2.2g÷44g/mol =0.05mol;水的物质的量为1.8g÷18g/mol =0.1mol;生成CuO的物质的量为8.0g÷80g/mol =0.1mol,根据原子守恒可知,碳、氢、铜的原子数目比为C:H:Cu=x:(2y+2z):(x+y)=0.05:0.2:0.1,解得x:y:z=1:1:1,即样品的组成为:CuCO3·Cu(OH)2·H2O 。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
该工艺的主要流程如下。

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式_________。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下图)。其中a、c二步的化学方程式可表示为_________________,______________。
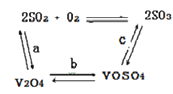
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数为_________,控制温度的方法为_________________。
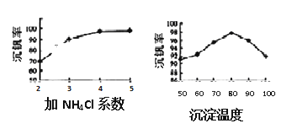
(4)将滤液1和滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子反应方程式为___。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中_________。

A.先分解失去H2O,再分解失去NH3 B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3D.同时分解失去H2、N2和H2O
(6)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2+ + V2++2H+ ![]() VO2+ +H2O +V3+。电池充电时阳极的电极反应式为___________。
VO2+ +H2O +V3+。电池充电时阳极的电极反应式为___________。