题目内容
19.A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种蓝色盐溶液X,用如图所示方法可将它们依次确定.
试确定A、B、C、D、X各代表哪种溶液.
X:CuSO4
A:NaOH
B:NaNO3
C:Ba(NO3)2
D:HNO3.
分析 根据物质间的相互反应及反应现象推断,物质X与这四种物质分别混合能生成一种白色沉淀和一种蓝色沉淀,NaNO3、HNO3不能与其他物质反应生成沉淀,沉淀是由NaOH和Ba(NO3)2和X反应生成的,那么白色沉淀应为硫酸钡;蓝色沉淀为氢氧化铜能溶于硝酸,硫酸钡不溶于硝酸.
解答 解:因为NaNO3、HNO3不能与其他物质反应生成沉淀,故X与NaOH和Ba(NO3)2反应生成蓝色沉淀和白色沉淀,实质就是X中的金属离子和氢氧根能结合成蓝色沉淀,X中的酸根离子和钡离子结合成白色沉淀,故X应该是CuSO4,生成的白色沉淀是硫酸钡,蓝色沉淀是氢氧化铜溶于硝酸,硫酸钡不溶于硝酸,由此可推断则A是NaOH,B是NaNO3,C是Ba(NO3)2,D是HNO3,X是CuSO4.
故答案为:CuSO4;NaOH;NaNO3;Ba(NO3)2;HNO3.
点评 本题考查无机物的推断,注意不溶性碱都能溶于稀硝酸,硫酸钡不溶于稀硝酸,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
13.下列关于某些离子的检验及结论,一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| C. | 加入稀硝酸无明显现象,再加入硝酸银有白色沉淀产生,则一定有Cl- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ba2+ |
14.下列各项操作中,不发生先沉淀后溶解现象的是( )
①向饱和Na2CO3溶液中通入过量的CO2
②向Na2SiO3溶液中逐滴加入过量稀硫酸
③向Ba(NO3)2溶液中通入过量的SO2
④向石灰水中通入过量的CO2气体
⑤向AlCl3溶液中逐滴滴加NaOH溶液至过量.
①向饱和Na2CO3溶液中通入过量的CO2
②向Na2SiO3溶液中逐滴加入过量稀硫酸
③向Ba(NO3)2溶液中通入过量的SO2
④向石灰水中通入过量的CO2气体
⑤向AlCl3溶液中逐滴滴加NaOH溶液至过量.
| A. | ①②③④ | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③ |
4.某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱.
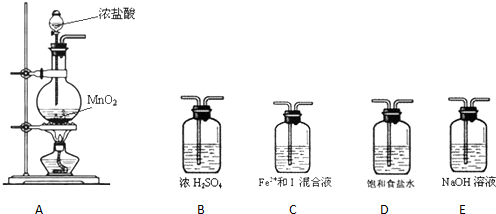
【提出假设】假设1:Fe2+还原性比I-强.假设2:I-还原 性比Fe2+强.假设3:一样强
【验证假设】(1)设计如下几种装置进行实验:
实验 必须的装置是A→C→E(按Cl2气流方向的顺序填写)
(2)实验开始后,控制通入 少量氯气,通过观察混合溶液颜色的变化不能(填“能”或“不能”)判断反应的先后顺序.
(3)请在下表中写出实验步骤及预期现象和结论.
(4)为了实验成功,必须控制各物质的量.该小组称取3.04gFeSO4,同时称取3.32gKI固体,溶于水中.为了验证上述假设,通入的Cl2体积 最多不能超过0.224L(标准状况).
【思考与交流】
(5)有同学质疑,上述实验只能验证Cl2分别与Fe2+和I-反应的速率大小,并不能证明Fe2+和I-还原性的强弱.于是提出另一方案:往KI溶液中滴入某溶液,如果能发生反应,即可证明I-的还原性强于Fe2+,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.

【提出假设】假设1:Fe2+还原性比I-强.假设2:I-还原 性比Fe2+强.假设3:一样强
【验证假设】(1)设计如下几种装置进行实验:
实验 必须的装置是A→C→E(按Cl2气流方向的顺序填写)
(2)实验开始后,控制通入 少量氯气,通过观察混合溶液颜色的变化不能(填“能”或“不能”)判断反应的先后顺序.
(3)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 | |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加KSCN溶液; 往B中滴加淀粉溶液. |
|
【思考与交流】
(5)有同学质疑,上述实验只能验证Cl2分别与Fe2+和I-反应的速率大小,并不能证明Fe2+和I-还原性的强弱.于是提出另一方案:往KI溶液中滴入某溶液,如果能发生反应,即可证明I-的还原性强于Fe2+,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
8.次氯酸可用于杀菌消毒.已知25°C时:
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| B. | 将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后的溶液,一定存在:2C(H+)-2C(OH-)=C(ClO-)-C(HClO) | |
| C. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
9.为达到相应的实验目的,下列实验的设计或操作最合理的是( )
| A. | 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 | |
| B. | 为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 | |
| C. | 为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 | |
| D. | 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂用标准盐酸溶液滴定 |
