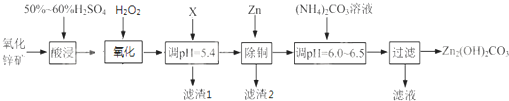
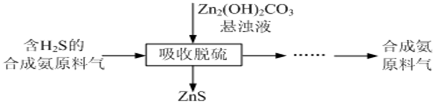
题目内容
8.次氯酸可用于杀菌消毒.已知25°C时:①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| B. | 将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后的溶液,一定存在:2C(H+)-2C(OH-)=C(ClO-)-C(HClO) | |
| C. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
分析 A、醋酸是弱酸,电离过程是吸热的过程,酸碱中和释放的热量和电离吸收热量的能量差即为反应热的数值;
B、将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后所得的溶液是次氯酸和次氯酸钠的混合物,根据溶液中的离子浓度关系来回答;
C、Na2SO3溶液中加入HClO,次氯酸将亚硫酸钠氧化为硫酸钠;
D、根据盐的水解规律:越弱越水解来比较离子浓度的大小.
解答 解:A、醋酸是弱酸,电离过程是吸热的过程,强酸碱的中和热是57.3kJ/mol,根据HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1,则次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=(57.3-Q1)kJ•mol-1,故A错误;
B、将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后所得的溶液是等浓度的次氯酸和次氯酸钠的混合物,根据电荷守恒:c(H+)+c(Na+)=c(OH-)+c(ClO-),根据物料守恒:2c(Na+)=c(ClO-)+c(HClO),整理两个等式得到2c(H+)-2c(OH-)=c(ClO-)-c(HClO),故B正确;
C、向Na2SO3溶液中加入HClO,次氯酸将亚硫酸钠氧化为硫酸钠,不会发生复分解反应,故C错误;
D、等浓度CH3COONa和NaClO的混合液中,由于酸性CH3COOH>HClO,所以次氯酸根离子水解程度大与醋酸钠根离子,C(ClO-)<C(CH3COO-),溶液显示碱性,所以C(Na+)>C(CH3COO-)>C(ClO-)>C(OH-)>C(H+),故D错误.
故选B.
点评 本题目综合考查学生反应热的大小比较、离子浓度大小比较以及溶液中离子浓度之间的关系,属于综合知识的考查,难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案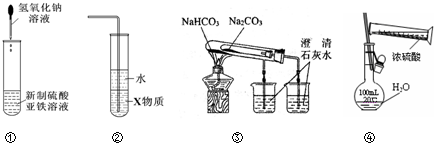
| A. | 利用装置①可制备氢氧化亚铁并长时间观察其颜色 | |
| B. | 装置②中X若为四氯化碳,可用于吸收HCl气体,并防止倒吸 | |
| C. | 装置③验证Na2CO3和NaHCO3两种固体的热稳定性 | |
| D. | 通过④的方法配制一定浓度的稀硫酸溶液 |
| A. | 水溶液为紫色 | B. | CCl4层呈橙色 | C. | CCl4层呈紫红色 | D. | 水溶液为橙色 |
 中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C | |
| D. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |
| A. | HNO3 | B. | H2O2 | C. | KClO3 | D. | Na2O2 |