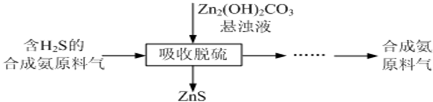
题目内容
7.有一无色澄清溶液中可能含有下列离子中的一种或几种:K+、Na+、OH-、Cl-、CO32-、Fe3+、SO42-.进行如下实验:a.取少量溶液滴入酚酞,溶液变红色.
b.另取少量溶液加盐酸至过量,有无色气体放出,再加BaCl2溶液,无沉淀生成.
c.另取少量溶液用硝酸酸化后,加入硝酸银溶液有白色沉淀生成.
(1)试推断,该溶液中肯定有OH-、CO32-、Cl-离子,肯定不存在Fe3+、SO42-离子;
(2)写出有关反应的离子反应方程式CO32-+2H+=CO2↑+H2O、Ag++Cl-=AgCl↓
(3)不能肯定存在K+、Na+离子.
分析 a.取少量溶液滴入酚酞,溶液变红色,说明溶液呈碱性,存在OH-,则不存在Fe3+;
b.另取少量溶液加盐酸至过量,有无色气体放出,生成二氧化碳,应存在CO32-,再加BaCl2溶液,无沉淀生成,说明不含SO42-;
c.白色不溶于硝酸的白色沉淀只有氯化银,说明含有Cl-,以此解答该题.
解答 解:a.取少量溶液滴入酚酞,溶液变红色,说明溶液呈碱性,存在OH-,则不存在Fe3+;
b.另取少量溶液加盐酸至过量,有无色气体放出,生成二氧化碳,应存在CO32-,再加BaCl2溶液,无沉淀生成,说明不含SO42-;
c.白色不溶于硝酸的白色沉淀只有氯化银,说明含有Cl-,
(1)由以上分析可知溶液中一定含有OH-、CO32-、Cl-;一定不含CO32-、Fe3+、SO42-,故答案为:OH-、CO32-、Cl-;Fe3+、SO42-;
(2)加入盐酸发生CO32-+2H+=CO2↑+H2O,用硝酸酸化后,加入硝酸银溶液有白色沉淀氯化银生成的方程式为:Ag++Cl-=AgCl↓,
故答案为:CO32-+2H+=CO2↑+H2O、Ag++Cl-=AgCl↓;
(3)K+、Na+是否存在不能确定,可以采用焰色反应来鉴别是否存在,故答案为:K+、Na+.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
1.在一个2L的容器内充入6.0mol某气态反应物,经过3S后,它的浓度变成1.2mol/L,在3S内用该反应物浓度的变化表示的反应速率为( )
| A. | 0.6mol•L-1•S-1 | B. | 0.8mol•L-1•S-1 | C. | 0.4mol•L-1•S-1 | D. | 2.4mol•L-1•S-1 |
19.下列各组内的离子,在溶液中不能大量共存的是( )
| A. | H+、SO42、Ba2+、NO3- | B. | Ca2+、H+、NO3、Cl | ||
| C. | Mg2+、K+、NO3-、Cl- | D. | K+、Na+、Mg2+、SO42- |
17.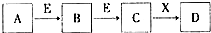 中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
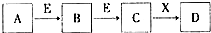 中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C | |
| D. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |