题目内容
在m A(g)+n B(g) p C(g)+q D(g)的反应中,经5 min达到平衡,测得A增加3 mol·L-1,B增加1 mol·L-1,C减少2 mol·L-1,此时若给体系加压,平衡不移动,则m∶n∶p∶q为( )
p C(g)+q D(g)的反应中,经5 min达到平衡,测得A增加3 mol·L-1,B增加1 mol·L-1,C减少2 mol·L-1,此时若给体系加压,平衡不移动,则m∶n∶p∶q为( )
| A.2∶3∶2∶3 | B.2∶2∶3∶3 |
| C.3∶1∶2∶2 | D.3∶1∶2∶3 |
C
解析

近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1)已知:850 ℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示: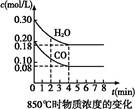
下列说法正确的是 (填序号)。
| A.达到平衡时,氢气的物质的量是0.12 mol |
| B.达到平衡时,反应体系最终会放出49.44 kJ热量 |
| C.第4 min时,混合气体的平均相对分子质量不再变化 |
| D.第6 min时,若升高温度,反应平衡常数会减小 |
(2)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
在密闭容器中存在如下反应:A (g)+3B(g) 2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断一定错误的是
| A.图Ⅰ研究的是压强对反应的影响,且乙的压强较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用催化剂的效率较高 |
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
| A.在该条件下,反应前后的压强之比为6?5.3 |
| B.若反应开始时容器体积为2 L,则有v(SO3)=0.35 mol/(L·min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
有甲、乙两个相同的恒容密闭容器,体积均为0.25 L,在相同温度下均发生可逆反应:X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时体系 能量的变化 | ||
| X2 | Y2 | XY3 | ||
| 甲 | 1 | 3 | 0 | 放出热量:23.15 kJ |
| 乙 | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.若容器甲体积为0.5 L,则平衡时放出的热量小于23.15 kJ
B.容器乙中达平衡时放出的热量Q=23.15 kJ
C.容器甲、乙中反应的平衡常数相等
D.平衡时,两个容器中XY3的体积分数均为1/7
某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
| A.K越大,达到平衡时,反应进行的程度越大 |
| B.K随着温度的升高而增大 |
| C.K越小,达到平衡时,反应物的转化率越大 |
| D.K随反应物浓度的改变而改变 |
图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )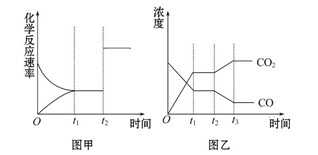
| A.图甲中t2时刻发生改变的条件是增大反应物的浓度 |
| B.图甲中t2时刻发生改变的条件可能是增大压强 |
| C.图乙中t2时刻发生改变的条件是升高温度 |
| D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气 |
纳米钴(Co)常用于CO加氢反应的催化剂,500 K时有催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
| A.纳米技术的应用,提高了催化剂的催化性能 |
| B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C.温度越低,越有利于CO催化加氢 |
| D.从平衡体系中分离出H2O(g)能加快正反应速率 |