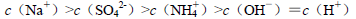题目内容
某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
| A.K越大,达到平衡时,反应进行的程度越大 |
| B.K随着温度的升高而增大 |
| C.K越小,达到平衡时,反应物的转化率越大 |
| D.K随反应物浓度的改变而改变 |
A
解析

一定条件下存在反应:CO(g)+H2O(g)  CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1 |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.Ksp(AgCl)>Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)=AgI(s)+ Cl-(aq)能够发生 |
| D.Ka(HCN)<Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
一定温度下,在固定容积的密闭容器中发生下列反应:2HI H2+I2。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
H2+I2。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
| A.等于5 s | B.等于10 s | C.大于10 s | D.小于10 s |
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
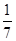
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)="0.40" mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
在m A(g)+n B(g) p C(g)+q D(g)的反应中,经5 min达到平衡,测得A增加3 mol·L-1,B增加1 mol·L-1,C减少2 mol·L-1,此时若给体系加压,平衡不移动,则m∶n∶p∶q为( )
p C(g)+q D(g)的反应中,经5 min达到平衡,测得A增加3 mol·L-1,B增加1 mol·L-1,C减少2 mol·L-1,此时若给体系加压,平衡不移动,则m∶n∶p∶q为( )
| A.2∶3∶2∶3 | B.2∶2∶3∶3 |
| C.3∶1∶2∶2 | D.3∶1∶2∶3 |
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
A.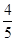 v(NH3)=v(O2) v(NH3)=v(O2) |
B.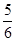 v(O2)=v(H2O) v(O2)=v(H2O) |
C.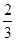 v(NH3)=v(H2O) v(NH3)=v(H2O) |
D.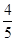 v(O2)=v(NO) v(O2)=v(NO) |
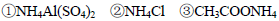
 由大到小的顺序是
由大到小的顺序是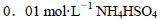 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性: