题目内容
下列图示与对应的叙述正确的是
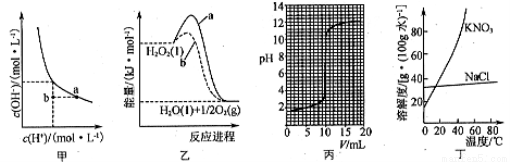
A.图甲为在水溶液中H+和OH-的浓度变化曲线,恒温稀释可实现a→b的转化
B.图乙为H2O2在有、无催化剂下的分解反应曲线b表示有催化剂时的反应
C.图丙可表示用0.0110mol/L盐酸滴定0.0110mol/L氨水时的滴定曲线
D.图丁为NaCl中混有少量KNO3,除去KNO3可在较高温度下制得浓溶液再冷却结晶、过滤、干燥
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
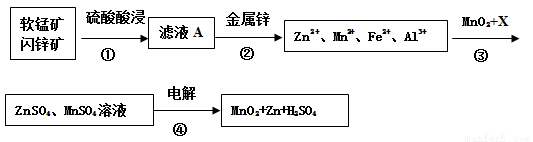
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________。
(3)步骤③中MnO2的其作用是__________________,另外一种物质X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是
A. 氯化银、溴化银和碘化银的溶解度依次增大
B. 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C. 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3 mol/L的AgNO3溶液,能观察到白色沉淀
D. 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成窗体顶端
下列物质的分离提纯方法选择不正确的是
A | 除去氯化钠溶液中的泥沙 | 过滤 |
B | 用四氯化碳提取溴水中的溴 | 萃取 |
C | 分离乙酸(沸点 118℃ )与乙酸乙酯(沸点 77℃ ) | 分液 |
D | 从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 | 结晶 |
A. A B. B C. C D. D


 Z(g)+W(s)ΔH>0下列叙述正确的是( )
Z(g)+W(s)ΔH>0下列叙述正确的是( ) 分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。