题目内容
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
(1)“酸溶”时加快反应速率的方法有________________________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2+ +2SO42-+16H+,则另一个反应的离子方程式为:___________________;②FeS2还原后,检验Fe3+是否反应完全的方法是_______________________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有____________杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_______________________。
(4)FeCO3浊液长时间暴露在空气中,会有部 分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO.现煅烧23.2kg的FeCO3,得到Fe2O3和FeO的混合物15.84kg.则Fe2O3的质量为___________kg。
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________________________
(中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示 剂)。请回答下列问题:
剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________。

(2)乙学生做了三组平行 实验,数据记录如下:
实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
滴定终点的判断__________________________


 2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。 2CO2(g)+N2(g)。ΔH<0
2CO2(g)+N2(g)。ΔH<0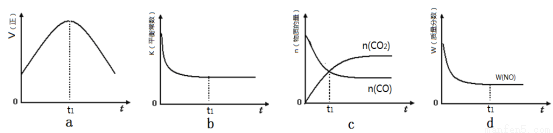

 。若有11.2LN2生成(标准状况),共消耗ClO2 g。
。若有11.2LN2生成(标准状况),共消耗ClO2 g。
 然高分子化合物
然高分子化合物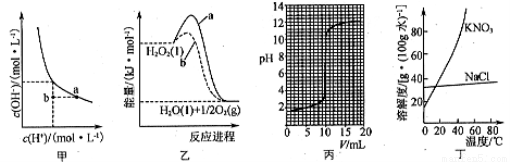
 区别
区别