题目内容
【题目】元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为____,第一电离能Ga____As(填“>”、 “<”、“=”)。
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是________________。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为_____,σ 键与 π 键数目之比为_______; (SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_________。
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_____________;②一定条件下(SCN)2可氧化为CO32—和SO32—等离子,其中SO32—的立体构型为_________。
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号________、_______;此晶体中 1 个 C22﹣周围距离最近的Ca2+为______个;若该晶胞的边长为a、a、b(nm),则该晶体的密度为______ g·cm-3(写出表达式)。

【答案】 ![]() < 硼和氮与镓和砷对比,原子半径前者更小(或电负性更大),形成的共价键键长BN小于GaAs(或前者键能更大),所以晶体的硬度和熔点前者更大 sp 3:4 异硫氰酸分子间可形成氢键,而硫氰酸不能 RbCl 三角锥型 N2 【答题空10】CO或NO+或CN- 6
< 硼和氮与镓和砷对比,原子半径前者更小(或电负性更大),形成的共价键键长BN小于GaAs(或前者键能更大),所以晶体的硬度和熔点前者更大 sp 3:4 异硫氰酸分子间可形成氢键,而硫氰酸不能 RbCl 三角锥型 N2 【答题空10】CO或NO+或CN- 6 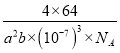 g/cm3或
g/cm3或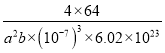 g/cm3或
g/cm3或![]() g/cm3或
g/cm3或![]() g/cm3
g/cm3
【解析】Ⅰ.(1)碳原子核内6个质子核外6个电子,基态原子的核外电子排布式为1s22s22p2,其2s、2p电子为价电子,根据构造原理知其价电子轨道表示式为![]() ; Ga和As处于同一周期,而处于第VA族的As外围电子处于半充满的较稳定结构,故Ga的第一电离能小于As。
; Ga和As处于同一周期,而处于第VA族的As外围电子处于半充满的较稳定结构,故Ga的第一电离能小于As。
(2)硼和氮位于第二周期,镓和砷位于第四周期,硼和镓同主族,氮和砷同主族,硼和氮与镓和砷对比,原子半径前者更小(或电负性更大),形成的共价键键长BN小于GaAs(或前者键能更大),所以晶体的硬度和熔点前者更大。
Ⅱ.(3)由题意,(CN)2的结构式为N≡C-C≡N,为直线型分子,故分子中氮原子的轨道杂化类型为sp杂化;单键为σ键,三键含有1个σ键、2个π键,则其分子中σ键与π键数目之比为3:4;由硫氰酸和异硫氰酸的结构式可知,异硫氰酸分子中有H—N键,异硫氰酸分子间可形成氢键,而硫氰酸不能,故异硫氰酸的沸点较高。
(4)①已知RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,因为氯离子的半径小于碘离子的半径,所以RbCl的离子键键长小于RbI的离子键键长,因此RbCl的晶格能较大,故A为RbCl;②SO32-中S形成3个σ键,孤电子对数为![]() =1,则为三角锥型。
=1,则为三角锥型。
(5)等电子体是指具有原子总数相同、价电子总数相同的微粒,C22-含电子数为2×6+2=14,与N2、CO、NO+、CN-等互为等电子体。因为CaC2 晶体中的哑铃形C22﹣的存在,使晶胞沿一个方向拉长,所以晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,同理1个C22﹣周围距离最近的Ca2+为4个。该晶胞的边长为a、a、b(nm),即a×10-7cm、a×10-7cm、b×10-7cm,所以晶胞体积为:a×10-7cm×a×10-7cm×b×10-7cm=a2b×(10-7)3cm3;由晶胞图可得1个晶胞含有Ca2+数为:1+![]() ×12=4,含有C22-数为:
×12=4,含有C22-数为: ![]() ×8+
×8+![]() ×6=4,所以1个晶胞的质量为:4×(40+12×2)g÷NA=
×6=4,所以1个晶胞的质量为:4×(40+12×2)g÷NA=![]() g,故该晶体的密度为:
g,故该晶体的密度为: ![]() g÷a2b×(10-7)3cm3=
g÷a2b×(10-7)3cm3= g/cm3(或
g/cm3(或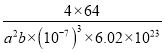 g/cm3或
g/cm3或![]() g/cm3或
g/cm3或![]() g/cm3)。
g/cm3)。

 阅读快车系列答案
阅读快车系列答案