题目内容
【题目】下列有关化学反应方向及其判据的说法中正确的是
A.非自发反应就是不可能发生的反应,自发反应就是能较快进行的反应
B.高温高压下可以使石墨转化为金刚石是自发的化学反应
C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.反应NH3(g)+HCl(g)![]() NH4Cl(s)在低温下能自发进行,说明该反应ΔH>0
NH4Cl(s)在低温下能自发进行,说明该反应ΔH>0
【答案】C
【解析】A.非自发反应在一定条件下也能发生,自发反应进行的也不一定较快,错误;B.高温高压下可以使石墨转化为金刚石,该反应是非自发进行的化学反应,错误;C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程,只要ΔG=ΔHTΔS<0,反应就可以自发进行,若ΔG>0,反应就不能自发进行,正确;D.反应NH3(g)+HCl(g)NH4Cl(s)在低温下能自发进行,ΔG=ΔHT·ΔS<0,从方程式知:ΔS<0,则TΔS<0,说明ΔH<0,错误。

【题目】SO2是高中化学重点学习大三大气体之一,是常见的大气污染物之一,同时有是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
①请在下表空白处填写相关实验现象。
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
②设计实验1的目的是_________。
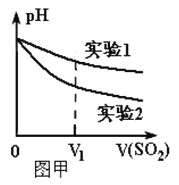
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲所示。实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

(1)若原料气从左向右流时,上述装置连接的顺序是:原料气→______ (用字母和箭头表示)。当装置②中出现_______现象时,立即停止通气。
(2)你认为下列试剂中,可以用来代替试管中的酸性KMnO4溶液的是________。(填字母代号)
A.NaOH溶液 B.溴水 C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行定性测定。
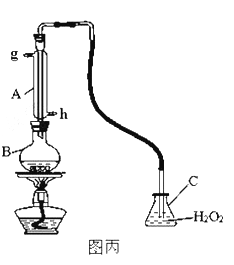
(1)B中加入250.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____。



