题目内容
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( ) 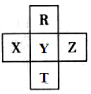
A.原子半径 Z>Y>R
B.R与Y的电子数相差8
C.非金属性:Z>Y>X
D.HZO4是目前无机酸中最强的含氧酸
【答案】A
【解析】解:Z单质与H2混合遇强光会发生爆炸,则Z的单质为氯气,Z为Cl元素;结合各Se元素,元素在周期表中的相对位置可知,R为O、X为P、Y为S、T为Se元素, A.电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则原子半径Y>Z>R,故A错误;
B.R为O、Y为S,原子序数分别为8、16,二者原子序数相差8,故B正确;
C.同一周期中,原子序数越大,非金属性越强,则非金属性:Z>Y>X,故C正确;
D.无机酸中最强的含氧酸为高氯酸,分子式为HClO4 , 是Z的最高价含氧酸,故D正确;
故选A.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应:2H2(g)+CO(g) ![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/molL–1 | 物质的平衡浓度/molL-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 500 | 0.40 | 0.20 | 0 | 0.160 |
II | 500 | 0.80 | 0.40 | 0 | |
III | 800 | 0 | 0 | 0.20 | 0.050 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大