��Ŀ����
����Ŀ����1���ڸ�����һ����̼�ɽ���������ԭΪ������
��֪����C(s)��O2(g)===CO2(g)����H1����393.5 kJ��mol��1
��CO2(g)��C(s)===2CO(g)����H2����172.5 kJ��mol��1
��S(s)��O2(g)===SO2(g)����H3����296.0 kJ��mol��1
��д��CO��SO2��Ӧ���Ȼ�ѧ����ʽ__________________________
��2����2 L�̶�������ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_______________________����֪��K300��>K350������÷�Ӧ��______��Ӧ������ȡ������ȡ�����
����ͼ��ʾNO2�ı仯��������__________����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��__________��

����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d���������ܶȱ��ֲ���
��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч����
���𰸡�2CO(g)��SO2(g)===S(s)��2CO2(g)����H����270 kJ��mol��1 ![]() ���� b 1.5��10��3 mol��L��1��s��1 bc c
���� b 1.5��10��3 mol��L��1��s��1 bc c
��������
(1)���ݸ�˹���ɽ���֪�ļ����Ȼ�ѧ����ʽ�Ӻ�������
(2)����дƽ�ⳣ������ʽʱע�⣺��������Ũ�ȵ���֮�������ӣ���Ӧ��Ũ�ȵ���֮������ĸ������K300��>K350����֪�¶�����ƽ�ⳣ����С��������Ũ�ȼ�С��ƽ�������ƶ��������������ԭ����������������������Ũ����ʱ��ı仯���ߣ�Ҫ������NO2�����ؼ�ʱ�������ʼ��1s��2sʱ�̡�ƽ��ʱ����Ũ��ֵ����ȷ��NO2�ı仯�������۸���������Ӧ�����Ƿ�����жϣ����߸���ijһ���������������������������ڷ�Ӧ��һֱ�ڱ仯���������������˵���÷�Ӧ�Ѵ�ƽ��״̬���ܸ���Ӱ�췴Ӧ���ʵ����غ���������ԭ���ۺϷ�����
(1)���ݸ�˹���ɽ���-��-�۵��Ȼ�ѧ����ʽ2CO(g)+SO2(g)=S(s)+2CO2(g); ��H=-393.5kJ/mol-172.5kJ/mol-(-296.0kJ/mol)=-270kJ/mol���������Ȼ�ѧ����ʽΪ2CO(g)+SO2(g)=S(s)+2CO2(g); ��H=-270kJ/mol��
(2)�ɱ������ݿ�֪�����淴Ӧ2NO(g)��O2(g)![]() 2NO2(g)�ڵ�3s��4s��5s�Ѵ���ƽ��״̬����ƽ�ⳣ����������Ũ�ȵ���֮���뷴Ӧ��Ũ�ȵ���֮���ı�ֵ��
2NO2(g)�ڵ�3s��4s��5s�Ѵ���ƽ��״̬����ƽ�ⳣ����������Ũ�ȵ���֮���뷴Ӧ��Ũ�ȵ���֮���ı�ֵ��![]() ����K300��>K350�������¶����ߣ�3000C��3500C��ƽ�ⳣ����С��������Ũ�ȼ�С��Ӧ��Ũ������ƽ�����淴Ӧ�����ƶ���������������ԭ�����淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ�����Ը÷�Ӧ�Ƿ��ȷ�Ӧ��
����K300��>K350�������¶����ߣ�3000C��3500C��ƽ�ⳣ����С��������Ũ�ȼ�С��Ӧ��Ũ������ƽ�����淴Ӧ�����ƶ���������������ԭ�����淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ�����Ը÷�Ӧ�Ƿ��ȷ�Ӧ��
���ɱ���������֪��0~2s��NOת�������ʵ���Ϊ0.02mol-0.008mol=0.012mol�����ݻ�ѧ��������ϵNO~NO2��֪0~2s������NO2���ʵ���Ϊ0.012mol������2sʱNO2��Ũ��c(NO2)=![]() =0.006mol/L(��NO2��ʼŨ��Ϊ0)��ͬ��ƽ��ʱc��NO2��=0.0065mol/L����ͼ���Ͽ�ֻ��b���߷��ϣ�0~2s����NO2��ʾ��ƽ����Ӧ����Ϊ
=0.006mol/L(��NO2��ʼŨ��Ϊ0)��ͬ��ƽ��ʱc��NO2��=0.0065mol/L����ͼ���Ͽ�ֻ��b���߷��ϣ�0~2s����NO2��ʾ��ƽ����Ӧ����Ϊ![]() ����O2��ʾ��ƽ����Ӧ����
����O2��ʾ��ƽ����Ӧ����![]() =1.5��10��3 mol��L��1��s��1��
=1.5��10��3 mol��L��1��s��1��
��a.����v(NO2)��2v(O2)����ȷ���ÿ��淴Ӧ�������淴Ӧ�����Ƿ���ȣ���ȷ���÷�Ӧ�Ƿ��Ѵ�ƽ��״̬��a�����b.���ݰ����ӵ����ɼ�������֪����ͬ�¶Ⱥ�����£��κ������ѹǿ�������������ȣ����ڿ��淴Ӧ2NO(g)��O2(g)![]() 2NO2(g)��˵��Ӧǰ�������������ͬ������ڵ���ƽ��ǰ����������ѹǿһֱ�ڱ仯������������ѹǿ���ֲ�����˵���÷�Ӧ�Ѵﵽƽ��״̬��b����ȷ��c.����v��(NO)��2v��(O2)����v��(NO)��v��(O2)=2:1����ͬ���ʱ�ʾ�������淴Ӧ����֮�ȵ��ڼ�����֮�ȣ�������ʱ�����淴Ӧ������ȣ���Ӧ�Ѵ�ƽ��״̬��c����ȷ��d.�����������������������������ڷ�Ӧ�����ж�û�б仯�������ܶȹ�ʽ
2NO2(g)��˵��Ӧǰ�������������ͬ������ڵ���ƽ��ǰ����������ѹǿһֱ�ڱ仯������������ѹǿ���ֲ�����˵���÷�Ӧ�Ѵﵽƽ��״̬��b����ȷ��c.����v��(NO)��2v��(O2)����v��(NO)��v��(O2)=2:1����ͬ���ʱ�ʾ�������淴Ӧ����֮�ȵ��ڼ�����֮�ȣ�������ʱ�����淴Ӧ������ȣ���Ӧ�Ѵ�ƽ��״̬��c����ȷ��d.�����������������������������ڷ�Ӧ�����ж�û�б仯�������ܶȹ�ʽ![]() �����Է�Ӧ�������������ܶ�һֱû�б仯���������ܶȱ��ֲ��䣬����˵���÷�Ӧ�Ѵ�ƽ��״̬��d�����ѡbc��
�����Է�Ӧ�������������ܶ�һֱû�б仯���������ܶȱ��ֲ��䣬����˵���÷�Ӧ�Ѵ�ƽ��״̬��d�����ѡbc��
��a.�����NO2���壬������NO2��Ũ�ȼ�С����Ӧ���ʼ�����a�����b.�����¶ȷ�Ӧ����������Ϊ�÷�Ӧ�Ƿ��ȷ�Ӧ���淴Ӧ�����ȷ�Ӧ��������������ԭ���������¶ȸ�ƽ�����淴Ӧ�����ƶ���b�����c. ����O2��Ũ�ȣ���Ӧ������������������ԭ�������ӷ�Ӧ��Ũ��ƽ��������Ӧ�����ƶ���c����ȷ��d.ʹ�ô�����ʹ��Ӧ��������ƽ�ⲻ�����ƶ���d�����ѡc��

 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д� ��ɢ˼ά�¿���ϵ�д�
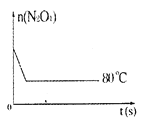
��ɢ˼ά�¿���ϵ�д�����Ŀ����80��ʱ��0.40mol��N2O4�������2L�Ѿ���յĹ̶��ݻ����ܱ������з������·�Ӧ��N2O4![]() 2NO2��Q����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2��Q����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
ʱ�䣨s��n��mol�� | 0 | 20 | 40 | 60 | 80 | 100 |
n��N2O4�� | 0.40 | a | 0.20 | c | d | e |
n��NO2�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
��1������20s��40s����N2O4��ʾ��ƽ����Ӧ����Ϊ____��
��2���÷�Ӧ��ƽ�ⳣ��K=___��
��3����Ӧ������100s��Ӧ�������¶Ƚ��ͣ�����������ɫ___��������dz��������������������������
��4��Ҫ����÷�Ӧ��Kֵ���ɲ�ȡ�Ĵ�ʩ�У�����ţ�___����Ҫ���´ﵽƽ��ʱ��ʹ[NO2]/[N2O4]ֵ��С���ɲ�ȡ�Ĵ�ʩ�У�����ţ�___��
A������N2O4����ʼŨ�� B������������ͨ��NO2
C��ʹ�ø�Ч���� D�������¶�
��5����ͼ��80��ʱ������N2O4���ʵ����ı仯���ߣ����ڸ�ͼ�в������÷�Ӧ��60��ʱN2O4���ʵ����ı仯���ߡ�____
����Ŀ����Դ�������������������ᷢչ������ء�
��1����ҵ������CO��H2�ڴ��������ºϳɼ״���CO(g)+2H2(g) ![]() CH3OH(g) ����֪��Ӧ���й����ʵĻ�ѧ�������������±���ʾ��
CH3OH(g) ����֪��Ӧ���й����ʵĻ�ѧ�������������±���ʾ��
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
�� CO(g)+2H2(g) ![]() CH3OH(g) ��H=__________kJmol-1
CH3OH(g) ��H=__________kJmol-1
��2���Լ״�Ϊȼ�ϵ����͵��,��ɱ�������������Ϊȼ�ϵĴ�ͳȼ�ϵ�ء���ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ��

B��Ϊ���______����B���ĵ缫��ӦʽΪ_________________________________��
��3���ο��ϳɷ�ӦCO(g)+2H2(g) ![]() CH3OH(g)��ƽ�ⳣ�����ش��������⣺
CH3OH(g)��ƽ�ⳣ�����ش��������⣺
�¶�/�� | 0 | 50 | 100 | 200 | 300 | 400 |
ƽ�ⳣ�� | 667 | 100 | 13 | 1.9��10-2 | 2.4��10-4 | 1��10-5 |
�ٸ÷�Ӧ����Ӧ�� ___________��������������������������Ӧ��
����T��ʱ��1L�ܱ������У�Ͷ��0.1molCO��0.2molH2���ﵽƽ��ʱ��COת����Ϊ50%����T=__________�档
��4��CH3OHҲ����CO2��H2�ϳɡ������Ϊ1L���ܱ������У�����lmolCO2��3molH2��һ�������·�Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H= �� 49.0kJ/mol�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H= �� 49.0kJ/mol�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ��ʾ��
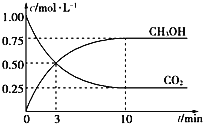
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK=_______���ӷ�Ӧ��ʼ��10min��v(H2)=_____mol/(L��min)��
�����������˵���÷�Ӧһ���ﵽƽ��״̬����___________(����ĸ)
A��v(CO2)���� = v(CH3OH)����
B��������ܶȲ�����ʱ��ı�
C��CO2��CH3OH��Ũ��֮�Ȳ�����ʱ��ı�
D�������ƽ����Է�������������ʱ��ı�
��Ϊ�˼ӿ컯ѧ��Ӧ������ʹ��ϵ����������ʵ�������ֻ�ı�����ijһ�������ɲ�ȡ�Ĵ�ʩ��__ (����ĸ)
A�������¶� B����С�������
C���ٳ���CO2���� D��ʹ�ú��ʵĴ���
����ͬ�¶��£�����һ���ݻ�Ϊ1 L���ܱ������г���2mol CH3OH(g)��2molH2O(g)���ﵽƽ��ʱCO2��Ũ��_______(����>������ <������=��)0.25mol/L��






