��Ŀ����
����Ŀ������������
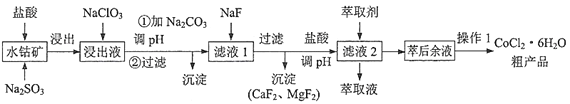
��1��ijʵ��С��ͬѧ��������ʵ�飬�Լ��黯ѧ��Ӧ�е������仯��ʵ���з��֣���Ӧ����е��¶����ߣ����е��¶Ƚ��ͣ��ɴ��ж�����������ķ�Ӧ��___________�ȷ�Ӧ��Ba��OH��28H2O��NH4Cl�ķ�Ӧ��________________________�ȷ�Ӧ����Ӧ����___________________________����١��ڡ����������仯����ͼ2��ʾ��

��2��Ϊ����֤Fe3+��Cu2+������ǿ��������װ���ܴﵽʵ��Ŀ����_________������ţ���

��3����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ����ͼ4��ʾ��a��bΪ���̼�������缫���ͨ���飨��A��B������缫��ӦʽΪ_____________________ ��

��4����ͼ5��ij��ѧ��ȤС��̽����ͬ�����»�ѧ��ת��Ϊ���ܵ�װ�ã���ش��������⣺
�ٵ��缫aΪAl���缫bΪCu���������ҺΪϡ����ʱ��д����ԭ��������ĵ缫��ӦʽΪ___________________________ ��
�ڵ��缫aΪAl���缫bΪMg���������ҺΪ����������Һʱ����ԭ��ص�����Ϊ_______����ԭ��صĸ�����ӦʽΪ_____________________________��
���𰸡��� �� �� �� A��CH4��8e��+10OH��=CO32��+7H2O 2H++2e���TH2�� Mg Al+4OH����3e��=AlO2��+2H2O
��������
(1)��ѧ��Ӧ��,�¶�����,��Ӧ�������¶Ƚ�����Ӧ������ͼ2�з�Ӧ������������������������,�÷�ӦΪ���ȷ�Ӧ,�ݴ˽��н����
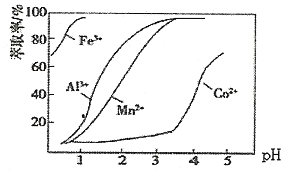
(2)��֤Fe3+��Cu2+������ǿ��,��ԭ�����,ͭ����������������Ľ�����ǽ���������,�������ҺΪ�����Ե�������
(3)���ݵ�������֪,AΪ������BΪ����,ȼ�ϵ����ͨ��ȼ�ϵĵ缫Ϊ������ͨ���������ĵ缫Ϊ����,����ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ��
(4)��Al��Cu��ϡ���ṹ�ɵ�ԭ���,����Al������,����CuΪ����,�����������ӵõ�����,������Alʧȥ������
��Al��Mg��NaOH��Һ���ɵ�ԭ�������AlΪ������MgΪ����,������Alʧȥ����,������ˮ�е������ӵõ��������Դ��������
(1)ͨ��ʵ����,��Ӧǰ����ձ��е��¶�����,��Al������ķ�Ӧ�Ƿ��ȷ�Ӧ,���ձ��е��¶Ƚ���,��Ba��OH��28H2O��NH4Cl�ķ�Ӧ�����ȷ�Ӧ������ͼ2���ݿ���֪��,�÷�Ӧ��,��Ӧ������������������������,��÷�ӦΪ���ȷ�Ӧ,�ɱ�ʾ��Ӧ�ٵ������仯����ˣ�������ȷ���ǣ��ţ� ���� �� ��
(2)��֤Fe3+��Cu2+������ǿ��,��ԭ�����,ͭ����������������Ľ�����ǽ���������,�������ҺΪ�����Ե����Σ�
��������������Cu������,��ط�ӦʽΪFe+2Fe3+=3Fe2+,������֤Fe3+��Cu2+������ǿ��,�ʴ���
����ͭ����������������,��ط�ӦʽΪCu+2Fe3+=2Fe2++ Cu2+������֤Fe3+��Cu2+������ǿ��,����ȷ��
�����������ۻ�����,Cu����������������,��ط�ӦʽΪ: Cu+4H++2NO3-=Cu2++2NO2��+2H2O��������֤Fe3+��Cu2+������ǿ�����ʴ���
��������������ͭ������,��ط�ӦʽΪ: Fe+ Cu2+= Cu2++ Fe2+��������֤Fe3+��Cu2+������ǿ�����ʴ���
��ˣ�������ȷ����:�ڡ�
(3)���ݵ�������֪,AΪ������BΪ����,ȼ�ϵ����ͨ��ȼ�ϵĵ缫Ϊ������ͨ���������ĵ缫Ϊ����,����A��ͨ�����,����ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ,�缫��ӦʽΪCH4��8e��+10OH��=CO32��+7H2O ��
��ˣ�������ȷ����:A��CH4��8e��+10OH��=CO32��+7H2O��
(4)��Al��Cu��ϡ���ṹ�ɵ�ԭ���,����Al������,����CuΪ����,�����������ӵõ�����,������Alʧȥ����,������ӦΪ2H++2e���TH2����
��ˣ�������ȷ������2H++2e���TH2����
��Al��Mg��NaOH��Һ�ɹ���ԭ���,AlΪ����,MgΪ����,������Alʧȥ����,������ˮ�е������ӵõ�����,����������ӷ�ӦΪAl+4OH����3e��=AlO2��+2H2O��
��ˣ�������ȷ���ǣ�Mg��Al+4OH����3e��=AlO2��+2H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����84������Һ����Ч�ɷ�Ϊ![]() ��������������Ư�ף�����ʵ������ķ�������ȷ����
��������������Ư�ף�����ʵ������ķ�������ȷ����
ʵ����� | ��
| �� | ��
|
ʵ������ | ��Ϻ���Һ�� | ��Ϻ���Һ | ��Ϻ���Һ |
A. �Ա�ʵ��ٺ͢ڣ�������ɫѸ����ȥ��ԭ���Ƿ����˷�Ӧ![]()
B. ʵ����в�����������![]() ����
����![]() �ֽ�õ���
�ֽ�õ���![]()
C. �Ա�ʵ��ںۣ͢���Һ��![]() ���ܻ�Ӱ��
���ܻ�Ӱ��![]() �������Ի�
�������Ի�![]() �Ļ�ԭ��
�Ļ�ԭ��
D. ������������84������Һ��Ư��Ч��������Ҫ���ص����ʵ�![]() ���ܰ�ȫʹ��
���ܰ�ȫʹ��
����Ŀ����1���ڸ�����һ����̼�ɽ���������ԭΪ������
��֪����C(s)��O2(g)===CO2(g)����H1����393.5 kJ��mol��1
��CO2(g)��C(s)===2CO(g)����H2����172.5 kJ��mol��1
��S(s)��O2(g)===SO2(g)����H3����296.0 kJ��mol��1
��д��CO��SO2��Ӧ���Ȼ�ѧ����ʽ__________________________
��2����2 L�̶�������ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_______________________����֪��K300��>K350������÷�Ӧ��______��Ӧ������ȡ������ȡ�����
����ͼ��ʾNO2�ı仯��������__________����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��__________��

����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d���������ܶȱ��ֲ���
��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч����