题目内容
17.用双线桥分析下列氧化还原反应中化合价变化、得失电子情况,并指出氧化剂和还原剂是什么.(1)H2+CuO═Cu+H2O
上面反应中,氧化剂是:CuO还原剂是:H2
(2)C+2CuO═2Cu+CO2↑
该反应中氧化剂是:CuO还原剂是:C.
分析 (1)Cu元素的化合价降低,H元素的化合价升高,转移的电子数为2e-;
(2)Cu元素的化合价降低,C元素的化合价升高,转移的电子数为4e-.
解答 解:H2+CuO═Cu+H2O中,H元素的化合价升高,H2为还原剂,CuO为氧化极,“双线桥”表示电子转移方向及数目为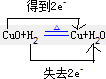 ,
,
故答案为:CuO;H2; ;
;
(2)C+2CuO═2Cu+CO2↑中,氧化铜中Cu的化合价由+2价降到0价,一氧化碳中C的化合价由+2升高到+4价,一氧化碳是还原剂,氧化铜为氧化剂,双线桥法为: ,
,
故答案为:CuO;C; .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意电子转移的表示方法,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.下列说法错误的是( )
| A. | 胶体粒子的大小在1~100nm之间 | |
| B. | 当光束通过NaCl溶液时会产生丁达尔效应 | |
| C. | 明矾在水中生成具有较强吸附能力的氢氧化铝胶体粒子,可作净水剂 | |
| D. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
5.(1)图表是某食品包装上的说明,表中列出了部分配料.
配料中,富含维生素的是③(填序号,下同),属于调味剂的是②属于防腐剂的是④,富含油脂的是①.
(2)请将下列食品或药品对应的序号填入相应空格处.
①胃舒平 ②阿司匹林 ③铁强化酱油 ④食用碘盐
预防甲状腺肿大应补充④,预防贫血应补充③,
感冒患者可服用②,胃酸过多患者可服用①.
| 配料 | ①食用油 ②盐 ③辣椒 ④苯甲酸钠 |
(2)请将下列食品或药品对应的序号填入相应空格处.
①胃舒平 ②阿司匹林 ③铁强化酱油 ④食用碘盐
预防甲状腺肿大应补充④,预防贫血应补充③,
感冒患者可服用②,胃酸过多患者可服用①.
12.下列电解质在水溶液中发生电离的电离方程式的书写不正确的是( )
| A. | Na2SO4═2Na++SO42- | B. | NaOH═Na++OH- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | Ca(OH)2═Ca2++(OH-)2 |
2.下列各组物质的性质比较,正确的是( )
| A. | 熔点:CO2<H2O<SiO2<KCl | B. | 稳定性:H2O<NH3<PH3<SiH4 | ||
| C. | 酸性:H3PO4>H2SO4>HClO4>H2SiO3 | D. | 粒子半径:K+>Na+>Mg2+>Al3+ |
9.下列说法或操作,其中正确的是( )
①配制一定物质的量浓度的溶液时将洗涤液直接倒入容量瓶
②用托盘天平称量25.28g KCl
③用酒精可以从饱和碘水中萃取碘
④让一束光通过胶体,从通过光线的方向可以看到一条光亮的“通路”
⑤从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可用结晶的方法.
①配制一定物质的量浓度的溶液时将洗涤液直接倒入容量瓶
②用托盘天平称量25.28g KCl
③用酒精可以从饱和碘水中萃取碘
④让一束光通过胶体,从通过光线的方向可以看到一条光亮的“通路”
⑤从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可用结晶的方法.
| A. | ①②③④⑤ | B. | ②④⑤ | C. | ④⑤ | D. | ⑤ |
6.amol H2中含有b个氢原子$\frac{a}{4b}$mol-1,则阿伏加德罗常数可以表示为( )
| A. | $\frac{b}{2a}$mol-1 | B. | $\frac{a}{4b}$mol-1 | C. | $\frac{a}{b}$mol-1 | D. | $\frac{b}{a}$mol-1 |