题目内容
【题目】请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
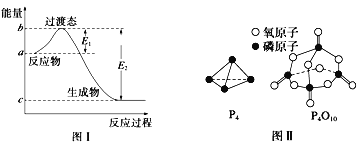
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”、“减小”或“不变”下同),△H的变化是________。请写出NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ/mol | a | b | c | x |
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O的个数为_______,表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。
【答案】减小不变NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234 kJ·mol-112 (d+6a+5c-12b)/4
【解析】
(1)加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)白磷燃烧的方程式为P4+5O2=P4O10,根据化学键的断裂和形成的数目进行计算。
(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1,故答案为:减小;不变;NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1;
(2)白磷燃烧的方程式为P4+5O2=P4O10,根据图示,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,所以12mol×bkJ/mol+4mol×xkJ/mol-(6mol×a kJ/mol+5 mol×c kJ/mol)=dkJ/mol,x=![]() kJ/mol,故答案为:12;
kJ/mol,故答案为:12;![]() 。
。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】一个化学电池的总反应方程式为:Zn+Cu2+═Zn2++Cu,该化学电池的组成可能为( )
A | B | C | D | |
正极 | Cu | Cu | Zn | Al |
负极 | Zn | Zn | Cu | Zn |
电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | Cu Cl2 |
A.A
B.B
C.C
D.D