题目内容
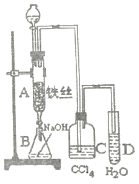
【题目】有四种原子:①![]() ②
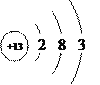
②![]() ③
③![]() ④
④![]()
(1)其中能与②形成离子键的是___________(填序号)。
(2)①的核外电子数是____;①和②形成的化学键是_____(填“极性键”或“非极性键”)。
(3)②和③互为同位素的本质原因是___________。
(4)④的原子结构示图是______________。
【答案】 ④ 1 极性键 质子数相同而中子数不同 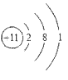
【解析】(1)根据活泼金属和活泼的非金属容易形成离子键分析解答;
(2)根据非金属元素原子间溶液形成共价键结合极性键和非极性键的概念判断;
(3)根据同位素的概念分析解答;
(4)钠原子核外11个电子,有三个电子层,最外层1个电子,据此写出原子结构示意图。
(1)阴阳离子间通过静电作用形成的化合物为离子化合物,④![]() 和②
和②![]() 通过得失电子形成离子化合物氯化钠,故答案为:④;
通过得失电子形成离子化合物氯化钠,故答案为:④;
(2)①![]() 的核外电子数是1;氢原子和氯原子以共用电子对形成共价化合物,电子对偏向氯原子形成极性键,①和②形成的化学键是极性共价键,故答案为:1;极性键;
的核外电子数是1;氢原子和氯原子以共用电子对形成共价化合物,电子对偏向氯原子形成极性键,①和②形成的化学键是极性共价键,故答案为:1;极性键;
(3)②![]() 和③
和③![]() 的质子数相同,中子数不同为氯元素的同位素,故答案为:质子数相同而中子数不同;
的质子数相同,中子数不同为氯元素的同位素,故答案为:质子数相同而中子数不同;
(4)钠原子核外11个电子,有三个电子层,最外层1个电子,原子结构示意图为 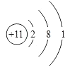 ,故答案为:
,故答案为: 。
。

【题目】请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
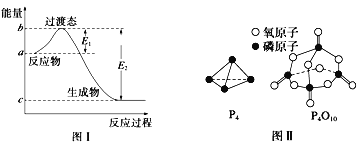
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”、“减小”或“不变”下同),△H的变化是________。请写出NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ/mol | a | b | c | x |
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O的个数为_______,表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。