题目内容
【题目】下图所示各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )。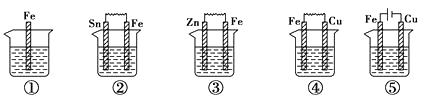
A.⑤②①③④
B.④③①②⑤
C.⑤④②①③
D.③②④①⑤
【答案】C
【解析】判断金属腐蚀快慢,首先判断该金属是充当原电池还是电解池的电极,若是电解池的阳极,金属腐蚀速率最快,其次是充当原电池的负极腐蚀较快,而作为电解池的阴极和原电池的正极不被腐蚀。其中第⑤,Fe作为电解池的阳极,腐蚀最快,②③④均为原电池,第③中,Fe为正极,不被腐蚀,②④中Fe均为负极被腐蚀,Fe和Cu的金属活动性差别较Fe和Sn大,④中铁腐蚀较快,其腐蚀速率由快到慢的顺序为⑤④②①③。
所以答案是:C
【考点精析】掌握金属的电化学腐蚀与防护是解答本题的根本,需要知道金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法.

【题目】Ⅰ.下表1是室温下,几种弱酸的电离平衡常数(Ka) 和弱碱的电离平衡常数(Kb)
表1
酸或碱 | 电离常数(ka或kb) |
CH3COOH | 1.75×l0-5 |
柠檬酸 (H3C6H5O7) | Kal=7.4×l0-4 Ka2=1.73×10-5 Ka3=4.0×l0-7 |
NH3·H2O | Kb=1.75×l0-5 |
请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是____________
A. ![]() B.c(H+) C.c(OH-)·c(H+) D.
B.c(H+) C.c(OH-)·c(H+) D. ![]()
(2)CH3COONH4的水溶液 呈_________(选填“酸性”、“ 中性”、“ 碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7) 溶液显________(填“酸”、“ 中”、“ 碱”)性,通过计算说明其原因____________。
Ⅱ.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。2CO2(g)-6H2(g)![]() CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
温度(K) CO2转化率 n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% /td> | 15% |
3.0 | 83% | 62% | 37% | 22% |
根据表中数据分析:
①上述反应的α__________0(填“大于” 或“小于”)。
②在一定温度下,提高氢碳(即![]() )比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
)比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
(2) 催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

在一定温度下,向上述密闭容器中加入1molCO、3molH2及固体催化剂,使之反应。平衡时,反应产生的热量为QkJ,若温度不变的条件下,向上述密闭容器中加入4molCO、12molH2及固体催化剂,平衡时,反应产生的热量为wkJ,则w的范围为___________。
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是__________________。使用上述乙醇燃料电池电解(Pt 电极)一定浓度的Na2CO3溶液,原理如图所示。阳极的电极反应式为____________________,阴极产生的物质A 的化学式为____________________。

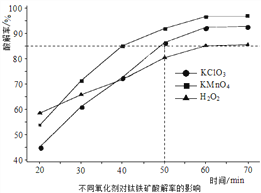
【题目】请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
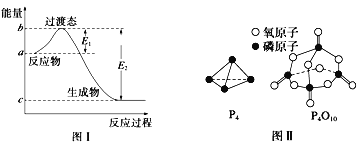
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”、“减小”或“不变”下同),△H的变化是________。请写出NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ/mol | a | b | c | x |
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O的个数为_______,表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。