题目内容
10.在5-氨基四唑(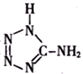 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.(1)基态Ga原子的电子排布式可表示为[Ar]3d104s24p1或1s22s22p63s23p63d104s24p1;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为N>C>H,在1mol 5-氨基四唑中含有的σ键的数目为9NA.
(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂.叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为直线形.
(4)GaAs(砷化镓)属于第三代半导体,它能直接将电能转变为光能,推广GaAs等发光(LED)照明,是节能减排的有效举措.
①下列说法正确的为ac(填选项字母)
a.GaP、SiC与GaAs互为等电子体
b.第一电离能:Ga>As
c.电负性:As>Ga
d.As、Cu都属于p区元素
②将(CH3)3Ca和AsH3在700℃的密闭容器中进行反应可制备GaAs,(CH3)3Ga中Ga原子的杂化轨道类型为sp2.
③AsH3沸点比NH3低,其原因为NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键.
分析 (1)Ga是31号元素,其核外有31个电子,根据构造原理写出其核外电子排布式;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)根据价层电子对互斥理论确定其空间构型;
(4)①a.等电子体的价层电子数相等;
b.同周期元素从左到右第一电离能逐渐增大;
c.同周期元素从左到右电负性逐渐增大;
d.根据砷和Cu的价层电子特点判断;
②根据反应物、生成物结合反应条件可书写化学方程式;利用价层电子对互斥模型判断分子的空间构型可杂化方式;
③从是否形成氢键的角度分析.
解答 解:(1)Ga是31号元素,其核外有31个电子,根据构造原理知,其核外电子排布式为:[Ar]3d104s24p1或1s22s22p63s23p63d104s24p1,
故答案为:[Ar]3d104s24p1 或1s22s22p63s23p63d104s24p1;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;9NA;
(3)N3-中价层电子对=2+$\frac{1}{2}$(5+1-2×3)=2,且该离子中不含孤电子对,所以其空间构型是直线形,故答案为:直线形;
(4)①a.GaP的价层电子为3+5=8,SiC的价层电子为4+4=8,GaAs价层电子数为3+5=8,则为等电子体,故a正确;
b.同周期元素从左到右第一电离能逐渐增大,则第一电离能:As>Ga,故b错误;
c.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故c正确;
d.砷的价层电子为sp电子,位于周期表p区,而Cu的外围电子排布为3d104s1,属于ds区元素,故d错误;
故答案为:ac;
②(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,故答案为:sp2;
③N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低,
故答案为:NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,涉及元素周期律的递变规律、分子空间构型以及杂化类型的判断、电子排布式以及氢键等知识,注意相关基础的把握和方法的积累.

①取少量原溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀;再加热,未见有气体放出;
②重新取少量原溶液,滴加适量的饱和氯水,有气泡生成,溶液呈现橙黄色;加入四氯化碳振荡、静置,四氯化碳层呈橙红色;分液后,向水层加入BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、NH4+、SO32-、Br | B. | 肯定有Mg2+、Br-、HCO3-、SO42- | ||
| C. | 肯定无Ag+、Cl-、I-、AlO2-、MnO4 | D. | 可能有K+、Cl-、SO42-、I- |
| A. | 在一定条件下,使煤和氢气作用,可以得到液体燃料,也可以获得洁净的燃料油 | |
| B. | (CH3)2CHCH(CH3)2的系统命名为:2,3-二甲基丁烷 | |
| C. | 硬脂酸甘油酯可以在稀硫酸中水解,也可以在NaOH溶液中发生皂化反应彻底水解 | |
| D. | 氨基酸分子中均含有氨基和羧基,加入浓的硫酸钠溶液可从溶液中析出 |
| A. | SO2和NaOH | B. | CO2和H2O | C. | Cl2和O3 | D. | CCl4和KCl |
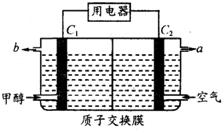 燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )
燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )| A. | b口放出气体为CO2 | |
| B. | 质子将由C1电极区经交换膜向C2电极区运动 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3 molCu | |
| D. | 电池总反应的产物与甲醇燃烧产物一样 |
| A. | 有机物就是仅有碳、氢两种元素组成的化合物 | |
| B. | 有机物都是非电解质,不能导电 | |
| C. | 组成符合CnHn的有机物分子一定互为同系物 | |
| D. | 含有醛基(-CHO)的有机物不一定是醛 |
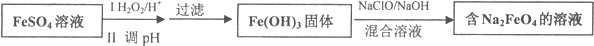
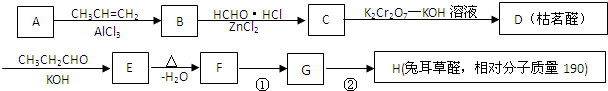
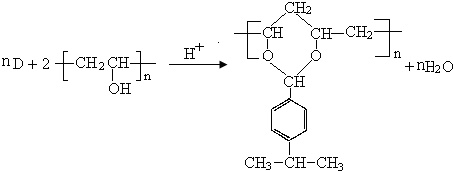
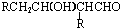 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$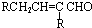
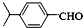 .
. .
.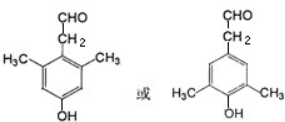 .
.